Un estudi internacional, amb la participació de UPF, desxifra els orígens de l’eina d’edició genètica CRIPSR de fa 2600 milions d’anys
Un estudi internacional, amb la participació de UPF, desxifra els orígens de l’eina d’edició genètica CRIPSR de fa 2600 milions d’anys
Un estudi internacional, amb la participació de UPF, desxifra els orígens de l’eina d’edició genètica CRIPSR de fa 2600 milions d’anys
Un estudi internacional liderat per científics espanyols, en el qual han participat els investigadors de la UPF Marc Güell i Avencia Sánchez-Mejías, desxifra l’origen de l’eina d’edició genètica CRIPSR i constata la seva activitat original
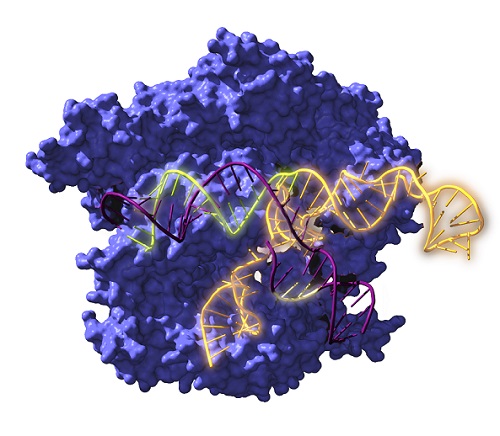
Un grup d’investigació internacional, amb la participació de la UPF, ha reconstruït per primera vegada ancestres del conegut sistema CRISPR-Cas de fa 2.600 milions d’anys i n’ha estudiat l’evolució al llarg del temps. Els resultats apunten que els sistemes revitalitzats no tan sols funcionen, sinó que són més versàtils que les versions actuals i podrien tenir aplicacions revolucionàries. Un article de la prestigiosa revista científica Nature Microbiology ha donat a conèixer els resultats d’aquesta investigació que, en opinió de l’equip investigador “obre noves vies per a l’edició genètica”.
En el projecte, dirigit per l’investigador Ikerbasque de CIC nanoGUNE Rául Pérez-Jiménez, participen equips del Consell Superior d’Investigacions Científiques, la Universitat d’Alacant, el Centre d’Investigació Biomèdica en Xarxa de Malalties Rares (CIBERER), i altres institucions estatals i internacionals. Per part de la UPF, hi ha participat el director del laboratori Translational Synthetic Biology, Marc Güell, juntament amb Avencia Sánchez-Mejías, que ha participat en aquest mateix grup de recerca de la Universitat.
Les seqüències repetitives CRISP de l’ADN de les bactèries emmagatzemen material genètic de virus que ha afectat els seus avantpassats, cosa que permet reconèixer-los i tallar l’ADN dels invasors mitjançant proteïnes Cas
L’acrònim CRISPR és el nom d’unes seqüències repetitives presents en l’ADN de bacteris i arqueobacteris (organismes procariotes). Entre les repeticions, aquests microorganismes alberguen fragments de material genètic de virus que han infectat els seus avantpassats, fet que els permet reconèixer si es repeteix la infecció i defensar-se tallant l’ADN dels invasors mitjançant proteïnes Cas associades a aquestes repeticions. Es tracta d’un mecanisme (sistema CRISPR-Cas) de defensa antiviral. Aquesta habilitat de reconeixement de seqüències d’ADN és la base de la seua utilitat, com si d’unes tisores moleculars es tractés. La tecnologia CRISPR-Cas permet avui dia tallar i enganxar trossos de material genètic en qualsevol cèl·lula, la qual cosa fa possible la seva utilització per a editar l’ADN.
Una forma radicalment diferent de trobar sistemes CRISPR és buscar-los en el passat, la base de la recerca
Els esforços d’investigació actuals se centren a trobar noves versions de sistemes CRISPR-Cas amb propietats diferents en els llocs més recòndits del planeta. Per a això, s’exploren sistemes de diferents espècies que habiten en entorns extrems o s’apliquen tècniques de disseny molecular per a modificar-los. Una forma radicalment diferent de trobar nous sistemes és cercar-los en el passat, que és precisament la base d’aquesta investigació.
Marc Güell (UPF): "Aquest estudi es contraposa amb l’estratègia clàssica, que és buscar enzims CRISPR a la natura en els temps actuals, per anar enrere en el temps per identificar sistemes CRISPR amb propietats molt interessants"
El grup de Nanobiotecnologia de nanoGUNE, liderat per Raúl Pérez-Jiménez, fa anys que estudia l’evolució de les proteïnes des de l’origen de la vida fins als nostres dies. Fan reconstruccions ancestrals de proteïnes i gens d’organismes extints per a observar quines qualitats tenen i si són utilitzables en aplicacions biotecnològiques. És un viatge en el temps dut a terme per mitjà de tècniques bioinformàtiques. En aquest treball, que acaba de ser publicat a la revista Nature Microbiology, han reconstruït per primera vegada la història evolutiva dels sistemes CRISPR-Cas, des d’ancestres de fa 2.600 milions d’anys fins a l’actualitat.
En la mateixa línia, el director del laboratori Translational Synthetic Biology de la UPF, Marc Güell, assegura: "Aquest estudi es contraposa amb l’estratègia clàssica, que és buscar enzims CRISPR a la natura en els temps actuals, per anar enrere en el temps per identificar sistemes CRISPR amb propietats molt interessants".
Lluís Montoliu (CSIC i CIBERER): “Resulta sorprenent que puguem revitalitzar proteïnes Cas que deurien existir fa milers de milions d’anys i constatar que llavors ja tenien la capacitat d’operar com a eines d’edició genètica, una cosa que hem confirmat en l’actualitat editant amb èxit gens en cèl·lules humanes”
L’equip d’investigació ha fet la reconstrucció informàtica de les seqüències CRISPR ancestrals, les ha sintetitzades, i ha estudiat i confirmat la seva funcionalitat. “Resulta sorprenent que puguem revitalitzar proteïnes Cas que deurien existir fa milers de milions d’anys i constatar que llavors ja tenien la capacitat d’operar com a eines d’edició genètica, una cosa que hem confirmat en l’actualitat editant amb èxit gens en cèl·lules humanes”, explica Lluís Montoliu, investigador del Centre Nacional de Biotecnologia del CSIC (CNB-CSIC) i del CIBERER, i responsable de l’equip que ha validat funcionalment aquestes Cas ancestrals en cèl·lules humanes en cultiu.
Francis Mojica (Universitat d’Alacant): “La pressió selectiva dels virus ha polit al llarg de milers de milions d’anys una maquinària rudimentària, poc selectiva en els inicis, fins a convertir-la en un sofisticat mecanisme de defensa”
Una altra conclusió interessant de l’estudi és que el sistema CRISPR-Cas ha anat fent-se més complex al llarg del temps, la qual cosa és un senyal del caràcter adaptatiu d’aquest, que s’ha adequat a les noves amenaces de virus que els bacteris han patit al llarg de l’evolució. “Aquesta investigació suposa un avanç extraordinari en el coneixement sobre l’origen i l’evolució dels sistemes CRISPR-Cas, en com la pressió selectiva dels virus ha polit al llarg de milers de milions d’anys una maquinària rudimentària, poc selectiva en els inicis, fins a convertir-la en un sofisticat mecanisme de defensa capaç de distingir amb una gran precisió el material genètic d’invasors indesitjats que ha de destruir, del seu ADN propi que ha de preservar”, afegeix l’investigador de la Universitat d’Alacant i descobridor de la tècnica CRISPR-Cas, Francis Mojica. En el vessant aplicat, “el treball representa una forma original de tractar el desenvolupament d’eines CRISPR per a generar nous instruments i millorar les derivades dels que hi ha en organismes actuals”, afegeix Mojica.
“Els sistemes actuals són molt complexos i estan adaptats per a funcionar dins d’un bacteri. Quan el sistema s’utilitza fora d’aquest entorn, per exemple, en cèl·lules humanes, el sistema immune provoca un rebuig i hi ha, a més, determinades restriccions moleculars que en limiten l’ús. Curiosament, en els sistemes ancestrals algunes d’aquestes restriccions desapareixen, fet que els confereix una major versatilitat per a noves aplicacions”, recalca Pérez-Jiménez.
Miguel Ángel Moreno, cap del Servei de Genètica de l’HRYC-IRYCIS-CIBERER apunta: “la ingenuïtat podria tenir una nucleasa ancestral, pel fet que no reconeix tan específicament algunes regions del genoma, les converteix en eines més versàtils per a corregir mutacions que fins ara eren no editables o es corregien de manera poc eficient”. El seu equip ha desenvolupat l’eina Mosaic Finder, que ha permès caracteritzar mitjançant seqüenciació massiva i anàlisi bioinformàtica l’efecte de l’edició del genoma produït per aquestes Cas ancestrals en cèl·lules humanes en cultiu.
Noves vies per tractar malalties com l’ELA, el càncer o la diabetis o per al diagnòstic d’altres patologies
Ylenia Jabalera, investigadora del projecte en nanoGUNE, sosté: “aquest èxit científic fa possible disposar d’eines d’edició genètica amb propietats diferents de les actuals, molt més flexibles, la qual cosa obri noves vies en la manipulació d’ADN i tractament de malalties com ara ELA, càncer, diabetis o, fins i tot, com una eina de diagnòstic de malalties”.
El treball és el resultat d’una investigació internacional de diversos centres i laboratoris liderat per nanoGUNE en col·laboració amb els grups de Francis Mojica, de la Universitat d’Alacant, qui va encunyar l’acrònim CRISPR; Lluís Montoliu, investigador del CNB-CSIC i del CIBERER i un dels referents sobre CRISPR a Espanya; Marc Güell de la Universitat Pompeu Fabra i Premi Nacional en Investigació i Transferència Tecnològica en el camp de l’edició de genomes amb finalitats terapèutics; Miguel Ángel Moreno-Pelayo, cap del servei de Genètica de l’Hospital Ramón y Cajal-IRYCIS, i membre del CIBERER, i Benjamin Kleinstiver de l’Hospital General de Massachusetts i de l’Escola de Medicina de Harvard, referent mundial en el disseny de sistemes CRISPR-Cas.
