Métodos
Antecedentes y estado actual
Este proyecto se basa sobre una extensa literatura previa. Resumimos de forma compacta los trabajos más relevantes y los avances que proponemos sobre el estado actual en la tabla siguiente:
- Área: Segmentación, Registro, Modelos estadísticos de forma
Trabajos previos: [Van Rixkoort et al.]
Avances que proponemos: Proponemos un modelos estadístico que unifica la forma y las posibles deformaciones debido a la ventilación pulmonar en la T.1.4
- Área: Mallado
Trabajos previos: [Bordas et al.]
Avances que proponemos: Usaremos una malla con una mejor calidad.
- Área: Modelos de ventilación y deposición basados en CFD
Trabajos previos: [Gemci et al.] [Nowak et al.]
Avances que proponemos: Usaremos un solver de desarrollo propio para entornos de HPC ofreciendo simulaciones, más precisos y realistas.
- Área: Modelos microscópicos de interacciones
Trabajos previos: [Chernyavsky et al.]
Avances que proponemos: Implementamos el trabajo teórico en modelos a agentes e incluimos el modelado de las células inmunes, no solo de la red regulatoria con las citoquinas.
En las secciones siguientes entramos más en detalle del estado del arte.
Modelos geométricos de las vías respiratorias
La estructura geométrica, tiene una gran influencia sobre los resultados funcionales [Galvin et al.]. Por esto, con el rápido avance de las técnicas de procesamiento de imágenes, se ha pasado desde el uso de geometrías sencillas en los primeros modelos pulmonares [Spencer et al.] a la generación directa de modelos anatómicos específicos de pacientes a partir de imágenes de CT. Existen varios métodos para la segmentación de las vías aéreas y de los lóbulos [Van Rixkoort et al.]. Los modelos estructurales de última generación utilizados para 3D CFD ahora son totalmente específicos del paciente, consistentes en mallas computacionales de alta resolución de las vías aéreas centrales (que normalmente incluyen 6-7 generaciones de ramificaciones) que contienen del orden de millones de elementos computacionales [De Backer et al.]. Sin embargo, las vías aéreas más pequeñas no están representadas actualmente en estos tipos de modelos debido a restricciones computacionales y de tiempo en el tamaño de las mallas. Un enfoque 1D simplificado es necesario para representar la estructura de la totalidad de las vías respiratorias y las redes vasculares. [Tawhai et al.] desarrolló un algoritmo de ramificación de volumen de relleno (VFB), que ha proporcionado un método morfométrico-realista para generar modelos de red específicos de pacientes.
Modelos basados en agentes para el modelado de EPOC
La investigación y la práctica clínica sugieren que la EPOC tiene dos escalas: una lenta a nivel molecular debido a la respuesta inflamatoria a partículas sólidas [Cosio et al.], y una rápida, causada por ruptura repentina de las paredes alveolares debido a fuerzas mecánicas que actúan en el tejido pulmonar durante la respiración [Suki et al.].
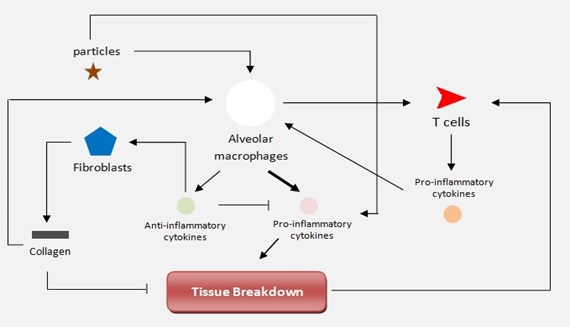 En la literatura existen numerosos trabajos previos en modelado del sistema inmune a nivel molecular. [Folcik et al.] desarrollaron un modelo basado en agentes para el sistema inmune innato y adaptativo. [Gary et al.] desarrollaron un modelo de agente basado en el epitelio. [Brown et al.] presentaron un modelo de inflamación con interacciones entre macrófagos y fibroblastos capaces de simular la cicatrización, daño tisular y fibrosis.
En la literatura existen numerosos trabajos previos en modelado del sistema inmune a nivel molecular. [Folcik et al.] desarrollaron un modelo basado en agentes para el sistema inmune innato y adaptativo. [Gary et al.] desarrollaron un modelo de agente basado en el epitelio. [Brown et al.] presentaron un modelo de inflamación con interacciones entre macrófagos y fibroblastos capaces de simular la cicatrización, daño tisular y fibrosis.
La mayoría de los estudios sobre modelado computacional del EPOC se enfocan solo en enfisema, centrándose principalmente en el cambio resultante en las propiedades mecánicas del tejido. El método más común utiliza una red 2D de muelles para representar el tejido alveolar [Mishima et al.]. Estos estudios de modelado han tenido el mérito de destacar la redistribución de fuerzas dentro del tejido durante la progresión del enfisema. Se vio que este método de progresión puede producir patrones de enfisema observado experimentalmente [Suki et al.] y fue extendido por [Parameswaran et al.] a 3D, utilizando células cuboidales para representar los alvéolos. Sin embargo poco o nada se hizo para modelar el restringimento o la oclusión de los bronquiolos por efecto de la fibrosis en el fenotipo de bronquitis crónica. El proyecto europeo AirProm ha iniciado el estudio de modelos multi-escala para el estudio de la EPOC [Burrowek et al.]
Hemos recientemente desarrollado en UPF un modelo donde la dinámica molecular de los procesos de respuesta inmune y su efecto sobre las propiedades mecánicas de la pared alveolar están explícitamente relacionados en un modelo completo [Ceresa et al 2017b]. Se asocian los modelos moleculares y biomecánicos a nivel celular.
Marcadores para el diagnóstico, pronóstico y seguimiento de la EPOC
El diagnóstico de esta enfermedad se basa en la clínica respiratoria y pruebas adicionales compatibles. Siguiendo las recomendaciones de la Global initiative for chronic Obstructive Lung Disease (GOLD) debemos tener una espirometría que muestre una obstrucción fija al flujo aéreo, es decir: relación de volumen espiratorio forzado en el primer segundo/capacidad vital forzada [VEF1/CVF] < 70% tras la prueba broncodilatadora. Para el diagnóstico diferencial con asma con respecto a los de EPOC podemos observar, debido a la variabilidad de la enfermedad, una espirometría normal. Lo más característico y diagnóstico es obtener una obstrucción reversible al flujo aéreo (reversibilidad igual o mayor al 12% del FEV1 tras broncodilatación). Además contamos con otras herramientas diagnósticas que nos pueden ayudar y apoyan el diagnóstico del asma como son: el óxido nítrico exhalado mayor a 50 ppm, una variabilidad del flujo espiratorio máximo mayor del 20% o una prueba de broncoconstricción positiva.
En cuanto al pronóstico del EPOC sabemos que la función pulmonar medida por el grado de obstrucción (FEV1) es importante. Sin embargo, a lo largo de los años se han ido incluyendo en las diferentes guías del manejo y tratamiento de ambas enfermedades otros factores de tipo clínico como la disnea, calidad de vida y sobretodo las reagudizaciones, ya que hemos descubierto que juegan un papel muy importante en el devenir de la enfermedad. Además se han desarrollado índices clínicos que se ha visto que son mejores a la hora de predecir mortalidad en pacientes con EPOC como el índice BODE que incluye parámetros antropométricos como el IMC, clínicos como la disnea, espirométricos como el grado de obstrucción (FEV1) y capacidad de ejercicio medido con el test de 6 minutos marcha.
Además se está dando cada vez más importancia al correcto fenotipo de los pacientes con EPOC para un tratamiento y seguimiento óptimos. En las guías españolas se diferencian 4 fenotipos diferentes teniendo en cuenta las reagudizaciones, la clínica de bronquitis crónica, la presencia de enfisema y finalmente un fenotipo mixto EPOC-asma. Con el uso cada vez más frecuente del TC de tórax estamos descubriendo que el enfisema juega un papel muy importante en la severidad y pronóstico del paciente fumador, incluso en aquellos que no han desarrollado obstrucción fija al flujo aéreo. Cada uno presenta un origen molecular distinto que originan caracteristicas clínicas, analíticas y funcionales diferentes, con impacto tanto a nivel pronóstico como de tratamiento.
Hay unos primeros estudios que combinan los modelos computacionales con las imágenes de pacientes para predecir la respuesta a la terapia como en [De Backer et al.] donde se considera el fenotipo de los pacientes y el control de la eficacia de las nuevas drogas respiratorias.
Modelo CFPD (Computational-Fluid-Particle-Dynamics) para la deposición de partículas
El equipo BSC tiene una gran experiencia en simulaciones de dinámica de fluidos que llevan a cabo a través del código modular multifísica Alya desarrollado por el mismo equipo. En la referencia [Houzeaux et al. 2013] se encuentra una amplia descripción del mismo.
La simulación del flujo en el sistema respiratorio presenta diferentes regímenes, laminar, transicional y turbulento así como geometrías complejas que requieren supercomputación para poder ser llevadas a cabo. El equipo BSC se ha enfrentado a este problema resolviendolo con un alto nivel de precisión. En particular, en [Calmet et al. 2016], se presenta un estudio del flujo en la inspiración para una malla de un paciente hasta la tercera generación del árbol broncopulmonar cuya geometría ha sido extraída vía una tomografía. La idea es determinar las zonas de transición entre régimen laminar y turbulento usando un modelo anatómico real y una alta resolución en la malla. trabajando con mallas de hasta 350 millones de elementos.
Durante la tesis de uno de los componentes del equipo de investigación se aplicó un método de acoplamiento de mallas no conformes que unía una geometría real de un paciente extraída de una tomografía hasta la parte baja de la tráquea con el árbol broncopulmonar. [Eguzkitza et al.]
El Dr. Houzeaux, co-IP del proyecto, forma parte de la COST (European Cooperation in Science and Technology) Action SiminHale: ”Simulation and pharmaceutical technologies for advanced patient-tailored inhaled medicines” [Cost]. Gracias a esta participación el equipo ha profundizado en la deposición localizada de medicamentos en las vías aéreas superiores a través de modelos turbulentos basados en LES (large eddy simulations) ofreciendo así mayor fiabilidad a los métodos in-silico. El trabajo desarrollado se puede consultar en [Koullapisa et al.]
En [Calmet et al. 2017] se amplía el estudio de la inspiración añadiendo la deposición de micro-partículas.
También se ha acoplado la simulación del flujo con el transporte de partículas optimizando los recursos computacionales, reto nada evidente el poder hacer un uso eficiente al resolver ambas físicas, como se describe en [Vazquez et al. 2016].
Otro de los puntos claves en las simulaciones del sistema respiratorio que también ha sido abordado por el equipo BSC como se muestra en [Cucchietti et al.] y [Artigues et al.] es la visualización de los resultados y desarrollo de herramientas que permitan una buena gestión de los mismos para así poder sacar el máximo partido de estas simulaciones.
Un ejemplo muy ilustrativo del trabajo que se ha desarrollado en las simulaciones sobre el sistema respiratorio se encuentra en el video creado por el mismo equipo que encontramos en [Breathe].
Todos estos esfuerzos están en la línea de las investigaciones que desde hace alrededor de 20 años se encuentran desarrollándose cada vez con más detalle sobre la complejidad del sistema respiratorio. Aún así, todavía hoy no encontramos simulaciones del sistema respiratorio completo que a su vez tenga en cuenta la simulación de la deposición de las partículas inhaladas y basadas en morfologías propias de pacientes. Y menos aún, simulaciones como las que hemos descrito que lleguen a la práctica clínica.
En general en la bibliografía encontramos simulaciones basadas en modelos matemáticos para la generación de la geometría o bien las basadas en imágenes clínicas. Una comparativa entre ambas la encontramos en [Nowak et al.]. También encontramos soluciones híbridas en [Tena et al.] como las planteadas en el subproyecto 1, aunque en esa referencia se llega hasta la generación 16 y con poca precisión numérica usando una aproximación para no resolver la mitad de las generaciones. En [Sul et al.] vemos un estudio del flujo a través de vías bajas (generaciones de la 8-14) con obstrucción generada automáticamente que abordan enfermedades como la EPOC.
La interacción del fluido con las paredes del tracto respiratorio, es un tema que también ha sido abordado y encontramos distintos métodos para su resolución. En [Wall et al. 2008] encontramos un estudio de la interacción entre el flujo de aire con sus paredes flexibles y deformables por el paso del mismo fluido. La geometría está basada en tomografías. Los investigadores del trabajo citado han hecho una gran investigación al respecto. Véase [Wall et al. 2010, Yoshihara et al.]
En cuanto a las simulaciones de las partículas en el sistema respiratorio, la gran mayoría emplea la denominada estrategia Lagrangiana y pocos son los que optan por modelos Eulerianos, como es el caso de [Mitsakou et al.]. Una comparativa entre ambas estrategias la encontramos en [Zhang et al.]. Existe mucha bibliografía relacionada con la deposición de partículas en las vías respiratorias, puesto que son muchos los parámetros que influyen en las deposiciones: tamaños de partícula, tipo de geometría, régimen del flujo, entre otras. Destacamos las revisiones que hacen en [Rostami et al., Longest et al.].
