Descobreixen com les cèl·lules controlen "el tall final" durant la divisió cel·lular
Descobreixen com les cèl·lules controlen "el tall final" durant la divisió cel·lular
Una nove recerca identifica com les cèl·lules utilitzen el canal iònic mecanosensible Piezo1 per a coordinar una de les propietats fonamentals d'una cèl·lula, la seva divisió en dues cèl·lules filles. La troballa estableix les bases per a comprendre aquesta etapa fonamental per al creixement i la renovació dels òrgans i aplana el camí per a abordar la proliferació descontrolada de cèl·lules canceroses.

La divisió cel·lular és un dels períodes més crítics del creixement i homeòstasi dels òrgans. Les cèl·lules del cos proliferen a diferents velocitats. Algunes es divideixen constantment i durant tota la vida, com les que recobreixen l'intestí, mentre que d’altres es divideixen només en rares ocasions. La divisió cel·lular és un procés fonamental per a la biologia, però també per a les malalties.
"La divisió cel·lular és un procés físic d'alta fidelitat que acaba amb la separació en dues cèl·lules filles, un procés conegut com a citocinesi".
La citocinesi, la separació d'una cèl·lula en dues cèl·lules filles, s'inicia amb l'escanyament de la cèl·lula mare al voltant de l'equador pels filaments que formen l'esquelet de la cèl·lula. A continuació, la contracció de les cèl·lules en l'equador i el moviment centrífug de les cèl·lules filles indueixen l'estrenyiment de la connexió entre les cèl·lules filles (Imatge 1). “És com separar un xiclet formant un fragment llarg i fi que acaba per trencar-se”, comenta Miguel A. Valverde, responsable del Laboratori de Fisiologia Molecular de la UPF i líder del projecte. El tram llarg i prim de la membrana plasmàtica i el citoplasma que connecta les dues cèl·lules filles es diu pont intercel·lular i el tall final que dóna com a resultat dues cèl·lules separades es diu abscisió.
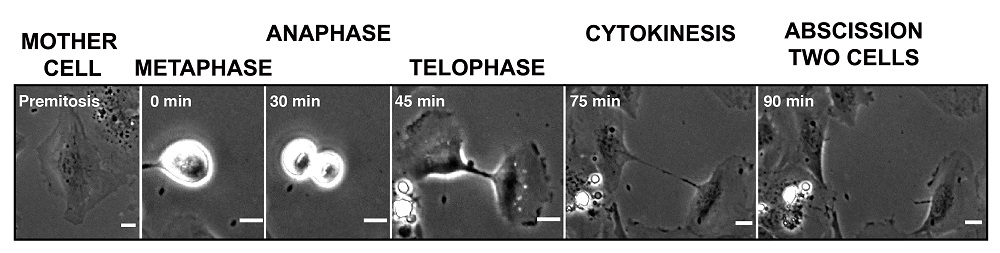
No obstant això, existeix una gran diferència entre el trencament passiu del xiclet degut a la força mecànica aplicada a l’estirar i la fascinant maquinària de precisió de l’abscisió. En el cas de l’abscisió, l'aprimament del pont intercel·lular forma un tub de menys d'un micròmetre (10-6 metres) de diàmetre amb l'objectiu d'adaptar la seva forma i mida a l'ancoratge de les proteïnes tipus molla cònica –i el seu reguladors– que escanyen la membrana plasmàtica per a generar dues cèl·lules independents. “Aquest tall final és un pas crític en la divisió cel·lular. No pot ocórrer massa aviat perquè les cèl·lules filles podrien no rebre tota la informació requerida, ni massa tard perquè les cèl·lules filles que se separen podrien fusionar-se novament en una sola cèl·lula però amb dos nuclis, adquirint així un nombre incorrecte de cromosomes, la qual cosa es coneix com a aneuploïdia, una característica significativa de nombrosos tipus de càncer”, afirma la Dra. Cristina Pujades, investigadora principal del grup de Biologia del Desenvolupament de la UPF.
“El càncer és sovint el resultat de mutacions en l'ADN o problemes en la divisió de les cèl·lules”.
Des del descobriment en el segle XIX que les cèl·lules es divideixen, els científics han tractat de desentranyar els mecanismes que operen en aquest procés d'alta precisió. “Raonem que durant la formació del pont intercel·lular entre les cèl·lules filles es produeix una tensió de la membrana plasmàtica que pot activar canals iònics mecanosensibles”, diu la Dra. Julia Carrillo, primera autora de la publicació científica.
El calci que ingressa a la cèl·lula després de l'activació de Piezo1 promou el reclutament de les proteïnes que formen el ressort cònic que escanya la connexió intercel·lular entre les cèl·lules filles.
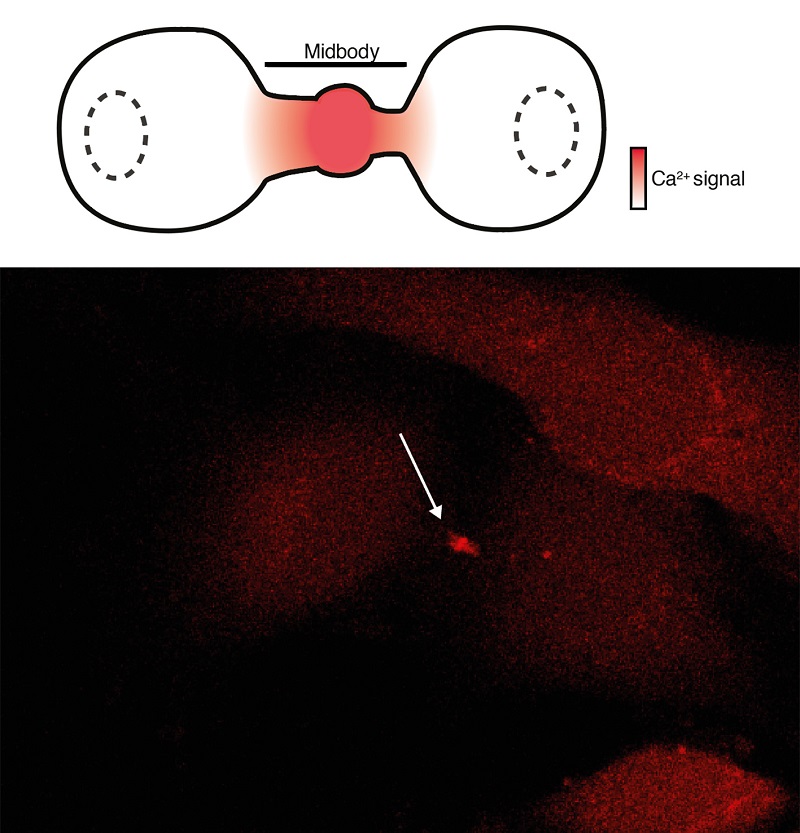 L'equip de la UPF va descobrir que durant la citocinesi, el canal iònic mecanosensible Piezo1 s'activa gairebé de manera única en el pont intercel·lular on genera un senyal de calci que es difon (Imatge 2). A més, van trobar que Piezo1 és necessari per a una citocinesi reeixida en diferents tipus de cèl·lules, incloses les cèl·lules endotelials que recobreixen l'interior dels vasos sanguinis, les cèl·lules que curen les nostres ferides, les cèl·lules del càncer de mama o en organismes complets com els embrions de peix zebra. En aquests l'activitat de Piezo1 es va reduir mitjançant silenciament genètic o una toxina obtinguda d'un escorpí que s'uneix específicament al canal Piezo1 inhibint la seva funció.
L'equip de la UPF va descobrir que durant la citocinesi, el canal iònic mecanosensible Piezo1 s'activa gairebé de manera única en el pont intercel·lular on genera un senyal de calci que es difon (Imatge 2). A més, van trobar que Piezo1 és necessari per a una citocinesi reeixida en diferents tipus de cèl·lules, incloses les cèl·lules endotelials que recobreixen l'interior dels vasos sanguinis, les cèl·lules que curen les nostres ferides, les cèl·lules del càncer de mama o en organismes complets com els embrions de peix zebra. En aquests l'activitat de Piezo1 es va reduir mitjançant silenciament genètic o una toxina obtinguda d'un escorpí que s'uneix específicament al canal Piezo1 inhibint la seva funció.
Les proteïnes dels canals iònics Piezo van ser identificades al 2010 com a sensors ràpids de forces mecàniques pel premi Nobel d'enguany, Ardem Patapoutian, i poc després van ser reconegudes com les molècules que el nostre sistema nerviós utilitza per a sentir el tacte. “Des del seu descobriment, nosaltres i altres laboratoris hem proposat que els canals Piezo no sols són rellevants per a detectar el món en el qual vivim, sinó que també són utilitzats per les cèl·lules per detectar i reaccionar al seu entorn físic quan s'estiren, comprimeixen o es mouen dins el nostre cos”, afirma el Dr. Valverde.
Piezo1 és necessari per a una citocinesi reeixida en diferents tipus de cèl·lules i espècies.
Aquestes troballes estableixen les bases per a comprendre aquesta breu i dinàmica etapa de la vida cel·lular que és fonamental per al creixement i la renovació dels nostres òrgans i aplana el camí per a abordar la proliferació descontrolada de cèl·lules canceroses en tumors mitjançant la regulació genètica o farmacològica del canal Piezo1.
Finançament:
Finançat pel Ministeri de Ciència, Educació i Universitats d'Espanya a través de les subvencions RTI2018-099718-B-100 a Miguel A. Valverde i PGC2018-095663-B100 a Cristina Pujades, un Programa institucional “Maria de Maeztu” d'Unitats d'Excel·lència en I + D al Departament de Ciències Experimentals i de la Salut (UPF) i fons FEDER.
Article de referència:
The mechanosensitive Piezo1 channel controls endosome trafficking for an efficient cytokinetic abscission. Julia Carrillo-Garcia, Víctor Herrera-Fernández, Selma A. Serra, Fanny Rubio-Moscardo, Marina Vogel-Gonzalez, Pablo Doñate-Macian, Covadonga F. Hevia, Cristina Pujades, Miguel A. Valverde. Science Advances 2021; 7: eabi7785, 29 October 2021. DOI: 10.1126/sciadv.abi7785.
