Health Policy Paper - Perspectivas económicas sobre la medicina de precisión
Health Policy Paper - Perspectivas económicas sobre la medicina de precisión
Introducción
El concepto de medicina de precisión hay que enmarcarlo en un informe de 2011 del National REsearch Council1 norteamericano que la define como “una nueva taxonomía de las enfermedades humanas basada en biología molecular”, es decir una innovación en el cuidado de la salud procedente del conocimiento obtenido de la secuenciación del genoma humano. Desde entonces, el campo ha evolucionado para reconocer cómo la interacción de datos multiómicos combinados con antecedentes médicos, determinantes sociales, comportamentales y ambientales permiten un conocimiento con mayor precisión de los estados de salud, de la enfermedad y las opciones terapéuticas para las personas afectadas.
El término medicina de precisión describe este nuevo marco de atención sanitaria y el término medicina personalizada mostrará el impacto de esta aproximación en el individuo que recibe atención. La medicina de precisión ofrece a los médicos la capacidad diferencial de conocer y presentar información que valida o modifica una decisión médica. Habitualmente se basa en la evidencia para el paciente promedio, y en medicina de precisión se basará en las características singulares del individuo, atendiendo a las bases moleculares de la enfermedad.
La medicina de precisión ofrece nuevas posibilidades que de lo contrario no existirían. En concreto, el genotipado y la secuenciación junto con la adopción de historias clínicas electrónicas y la oferta de nuevos biomarcadores ofrecen la capacidad de conseguir una decisión clínica más precisa y permiten validar la necesidad de tratamientos adicionales o mejorar el diagnóstico de variantes de la enfermedad. Además, la capacidad de la medicina de precisión para personalizar la atención está avanzando considerablemente a partir de la confluencia con Big Data y la Inteligencia Artificial.
La contribución al valor de la salud por parte de la medicina de precisión surge de distintos factores. Entre ellos debemos destacar los siguientes2.
- Orientar la terapia y reducir la incertidumbre al prescribir
- Reducir las reacciones adversas a los medicamentos
- Mostrar usos adicionales específicos para medicamentos y nuevos candidatos a fármacos
- Aumentar la adherencia del paciente al tratamiento
- Impulsar la prevención
- Reducir los procedimientos invasivos y de alto riesgo
- Contribuir a una atención sanitaria coste-efectiva
Sin embargo la palanca tecnológica decisiva para que estos factores contribuyan al valor de la salud, hay que buscarla en los biomarcadores3. El National Institutes of Health (NIH) estableció la definición de biomarcador como aquellas características biológicas, bioquímicas, antropométricas, fisiológicas, etc., objetivamente medibles, capaces de identificar procesos fisiológicos o patológicos, o bien una respuesta farmacológica a una intervención terapéutica. Un biomarcador se refiere pues a cualquier molécula del cuerpo humano que pueda ser medida para evaluar la salud y pueden obtenerse de derivados de sangre, fluidos corporales o tejidos. Ahora bien, a los efectos de la medicina de precisión nos interesa concretamente focalizar nuestra atención en los biomarcadores procedentes de tecnologías ómicas, es decir, biomarcadores genómicos, transcriptómicos, proteómicos, metabolómicos y microbiómicos.
Las tecnologías básicas que permiten la investigación ómica son los micro-arrays de expresión génica, la reacción en cadena de la polimerasa con transcriptasa inversa cuantitativa múltiplex (qRT-PCR), el análisis de secuencias de ADN, ARN y proteínas, y las técnicas de espectrometría de masas múltiple4.
La forma como estas tecnologías son capaces de modificar sustancialmente las decisiones clínicas y terapéuticas tiene que ver con los avances en el conocimiento científico y en especial en los ensayos clínicos farmacogenómicos. La translación de estas tecnologías hacia la práctica clínica es la fase clave de su posterior éxito.
En el ámbito de la oncología es donde podemos observar la mayor adopción de biomarcadores en ensayos clínicos. En 2019, aproximadamente la mitad de los ensayos oncológicos incluyeron biomarcadores relacionados con la eficacia, toxicidad o estratificación farmacogenómica de pacientes5.
Esta evolución en los ensayos clínicos, ha dado lugar que actualmente el 35% de los medicamentos aprobados por la FDA en el año 2021 sean ya basados en biomarcadores, y por consiguiente relativos a medicina de precisión. Son 17 nuevas moléculas y 2 terapias celulares, un 47% de ellas son para cáncer, un 37% para enfermedades raras y el resto a otras enfermedades5. Asimismo, se han admitido 20 nuevas indicaciones para moléculas ya aprobadas anteriormente.
Al mismo tiempo, el número de biomarcadores asociados a medicamentos sigue aumentando. A finales de 2021 había 50 biomarcadores aprobados por la FDA6. Más allá de los que representan un requisito para su prescripción, el número de pruebas diagnósticas genéticas autorizadas para distintas enfermedades es elevado y puede consultarse la información actualizada en la FDA6. Un informe reciente muestra que en la actualidad hay más de 75.000 pruebas genéticas que pueden solicitarse7. Ahora bien debemos distinguir entre las que se relacionan con el estado de salud y las que no (genética recreativa), las que se solicitan por el médico y las que se ofrecen directamente a la persona. Por todo ello, a la medicina de precisión lo que le interesa son tres tipos de pruebas genéticas, las que indican riesgo de enfermedad, las que indican efecto farmacológico, y las que tienen implicaciones hereditarias.
Resulta difícil estimar el alcance de la adopción de la medicina de precisión en la práctica clínica. Un estudio reciente en Estados Unidos muestra mediante datos de encuesta el impacto en oncología, enfermedades raras/no diagnosticadas, farmacogenómica, cribaje prenatal/neonatal, y cribaje de paciente sano. Los resultados son basados en encuesta y en aquel entorno, por consiguiente, convendría referirnos a datos más próximos. Un documento reciente muestra la situación general según Comunidades Autónomas en España sin una cuantificación precisa de la adopción7.
Mientras la medicina de precisión se dirige al paciente, debemos considerar asimismo la salud pública de precisión, la que se dirige a la población. La información obtenida de los biomarcadores a nivel poblacional puede permitir indicar estrategias en los ámbitos de impacto indicados anteriormente, y también en enfermedades infecciosas en la medida que la secuenciación genética sustituye las pruebas tradicionales y permite detección temprana de variantes8. Este ámbito está todavía en sus inicios, y cabe esperar nuevos desarrollos especialmente después de la pandemia de COVID-19.
Del conjunto de implicaciones que tiene la medicina de precisión, este artículo se centra en los aspectos económicos de la medicina de precisión. Un ejemplo del conjunto de implicaciones se muestra en el resumen de la figura 1, donde se reflejan los inputs y actividades, los outputs, los resultados y su impacto. En el apartado de los inputs, que habitualmente podemos mostrar como capital, tecnología y talento, se resumen en infraestructura, big data y recursos. Ello da lugar a un conjunto de actividades relativas a la investigación, la práctica clínica y la formación. El output es la decisión clínica y terapéutica diferencial fruto de la medicina de precisión, y los resultados tienen que ver con la utilidad clínica. Todo ello da lugar a un impacto en el valor de la salud (individual y poblacional), en la equidad y acceso, y en la evaluación del retorno de la inversión. Más allá de las precisiones que podamos incorporar a este esquema, se trata de un marco de referencia que puede ser objeto de consideración para el análisis de la medicina de precisión y en especial de sus aspectos económicos.
Figura 1. Implicaciones de la medicina de precisión
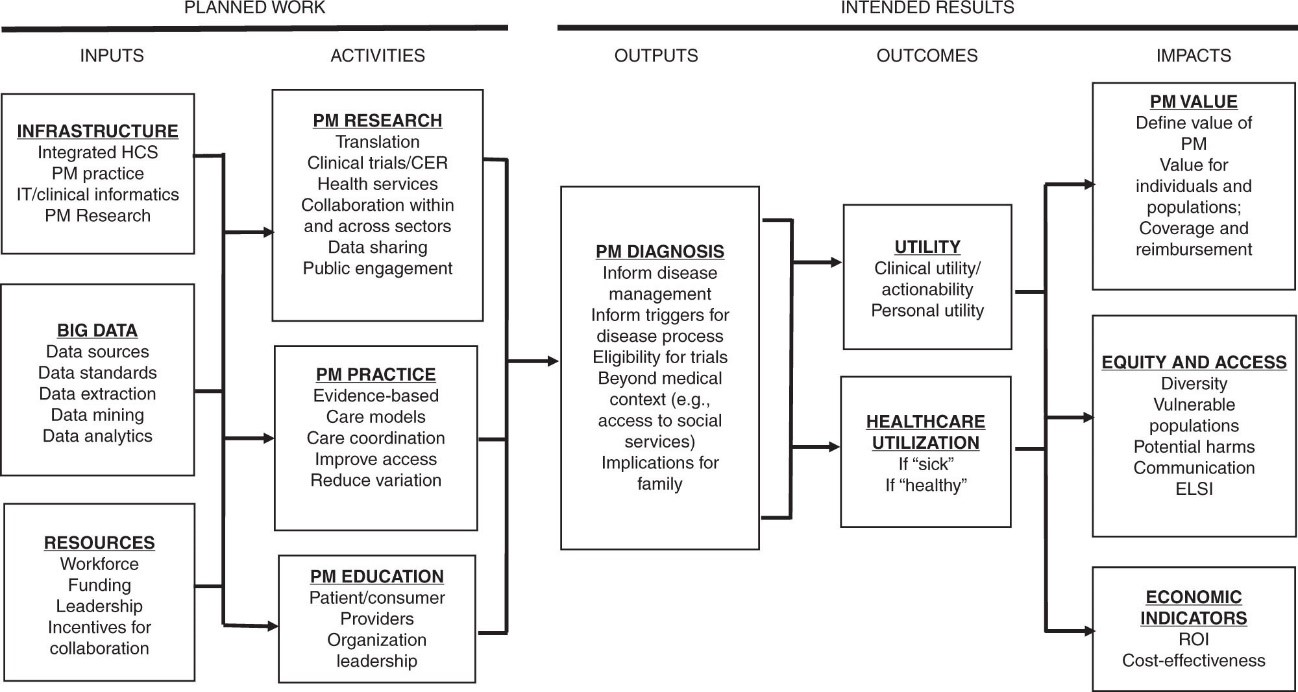
Nota: IT information technology, PM precision medicine, CER comparative effectiveness research, ELSI ethical, legal and social issues, HCS health-care system, ROI return on investment.
Las perspectivas de la economía sobre la medicina de precisión
En el año 2007 tuvo lugar un simposio en el congreso de la Society for Medical Decision Making que trató precisamente de lo que la economía podía aportar9 a la medicina de precisión. El debate inicial se situó en la evidencia sobre la efectividad y cuáles eran las iniciativas existentes para abordarla. En segundo lugar, se trataron cuestiones regulatorias, centradas en la estimación del riesgo y el papel de la FDA. En tercer lugar, se abordó la evaluación económica de la farmacogenómica y la utilización del valor de la información como metodología de priorización de los ensayos clínicos. En 2013 la revista Value in Health publicó un especial relativo a medicina de precisión10. Nuevamente se trataron temas similares. Ya entonces se indicaba que los QALYs previsiblemente no podrían captar el valor creado por la medicina de precisión11 y se apostaba por la generación de evidencia del mundo real (RWE)12.
Después de 15 años de aquel encuentro inicial, cabe reseñar que se ha avanzado de forma diversa. Por una parte, ha habido un desarrollo y adopción notable de la medicina de precisión como tecnología (aunque inferior al previsto inicialmente), pero por otra las dificultades metodológicas para su evaluación subsisten y trataremos de mostrar algunos detalles al respecto.
Si consideramos la medicina de precisión como la individualización del tratamiento a los pacientes y el ajuste a los cambios a la respuesta terapéutica, entonces podemos calificarla como un cambio en la función de producción. De esta forma la tecnología permitiría y ya permite modificar la forma que se produce para así conseguir mayor eficiencia, añadir mayor valor13. Ahora bien, esta expectativa que se originó a partir de 2003 con la secuenciación del genoma humano ha tenido una evolución desigual. A pesar de las promesas iniciales, la adopción de la medicina de precisión ha sido un camino largo que en la actualidad empieza a tener las características adecuadas para su generalización en múltiples ámbitos.
Los motivos para el retraso en la adopción de esta nueva función de producción han sido analizados en distintas publicaciones 14 3 y fundamentalmente tienen que ver con la traslación del conocimiento a la práctica clínica, con los incentivos a la adopción, con la regulación, con el coste y con el impacto organizativo y de formación de talento que representa.
Uno de los cambios decisivos que contribuyeron de forma radical fue la introducción de las técnicas de secuenciación de nueva generación (NGS), que permiten la descripción del genoma humano en días y a un coste asumible. Con ello cambió tanto la investigación como la práctica clínica. Si tomamos un ejemplo francés del coste de la secuenciación del exoma, observamos que ha disminuido sustancialmente, de 1921 € por muestra en 2015 a 804 € por muestra en 2018, lo que supone un descenso del 58 % en tan sólo tres años15. Es tan sólo una muestra del cambio sustancial que está sucediendo de forma acelerada. Así pues, el acceso a biomarcadores mejora en tiempo y coste. Y la información disponible para adoptar la medicina de precisión aumenta notablemente.
Los biomarcadores aportan distinta proporciona información clínica valiosa como: pronóstico, cuando el biomarcador es útil para predecir el resultado medio de un paciente; moderador, cuando el biomarcador es útil para predecir diferencia del resultado medio de los diferentes tratamientos potenciales; y prescriptivo, cuando el biomarcador es útil para seleccionar el tratamiento que maximiza el resultado medio. Atendiendo a sus diferentes facetas podemos intuir que el valor diferencial que aporta un biomarcador será diverso y a su vez su estimación compleja.
Hay asimismo aspectos regulatorios a considerar, y en especial el impacto de las patentes en la difusión de la tecnología. Para el caso de Estados Unidos en 2013 se estableció que no se podían patentar los genes humanos, la naturaleza no era patentable. Esta resolución fue clave para la reducción de coste y mejora del acceso a la tecnología16. Ahora bien, la ley de patentes europea proporciona una protección relativamente amplia para las patentes relacionadas con genes. La directiva europea sobre la protección de las invenciones biotecnológicas (98/44/EC) establece que las secuencias de ADN aisladas serán patentables en los Estados miembros europeos17 18. En cualquier caso, hay incertidumbre al respecto. Un ejemplo reciente de ello han sido las patentes sobre la tecnología CRISPR, que no son exactamente sobre genes sino sobre edición genética y que habían sido otorgadas inicialmente a la Universidad de California, Berkeley y en cambio se han asignado al Broad Institute después de un recurso sobre aquella decisión19. Se desconoce cuál será el impacto último de las patentes en el acceso a las tecnologías ómicas, tanto en el diagnóstico como en la terapia20.
En la medida que las aplicaciones concretas de la medicina de precisión difieren entre sí, convendría establecer patrones generales de qué cambio representa en la función de producción y para ello habría que atender a cada caso concreto y a su impacto en valor. Una muestra de ello se presenta en la Tabla 1 para relacionar la prueba diagnóstica con la población, el valor y las dificultades.
|
Prueba diagnóstica |
Población relevante y decisión |
Fuente de valor potencial |
Dificultades |
|---|---|---|---|
|
Receptor del factor de crecimiento epidérmico |
Para la decisión de prescripción de gefitinib en cancer de pulmón de células no pequeñas |
Mejora de la efectividad clínica |
Evidencia limitada de la efectividad de las pruebas para todos los diagnósticos |
|
Genotipado de mutaciones tiopurina S-metiltransferasa |
Para la decisión de prescripción azitioprina en enfermedades autoinmunes |
Reducción de los efectos adversos |
Adopción inadecuada de la estrategia diagnóstica |
|
Pruebas anticuerpos anti-drogas para medir farmacocinética |
Para la decisión de prescribir anticuerpos monoclonales en pacientes con factor de necrosis tumoral alfa |
Mejora de resultados de salud/utilización adecuada de recursos |
Momento de prescripción inadecuado o coste incierto
|
|
Panel de secuenciación de nueva generación |
Para el diagnóstico de la distrofia hereditaria de la retina |
Mejora en la precisión diagnóstica/utilización adecuada de recursos |
Restricciones de capacidad |
Fuente: Gavan SP, Thompson AJ, Payne K. The economic case for precision medicine. Expert Rev Precis Med Drug Dev. 2018;3(1):1-9.
El tamaño del mercado de la economía de precisión
El papel de los biomarcadores en la determinación del tamaño del mercado de la medicina estratificada fue descrita y analizada con detalle por parte de Berndt y Trusheim21. A pesar del tiempo transcurrido, este artículo mantiene su vigencia. En especial, por lo que señala respecto a la estimación del mercado en función del punto de corte del biomarcador, y la perspectiva de los pacientes y de la industria. La elección del punto de corte de un biomarcador (cut-off) determina la población sujeta a tratamiento y ello afecta a la rentabilidad del fármaco22. La empresa farmacéutica anticipará la situación y decidirá si vale la pena situar en el mercado un medicamento estratificado o no. Además, según sea la perspectiva (pacientes o industria) o el tratamiento, las preferencias por un punto de corte diferirán.
En algunos casos ideales, el punto de corte de una prueba separa perfectamente a la población que responde a un medicamento de la población que no responde. Si los que no responden son eliminados en un ensayo clínico, el efecto terapéutico observado aumentará. Sin embargo, otras distribuciones de población de pacientes no son dicotómicas y el punto de corte de una prueba diagnóstica no puede separar perfectamente a los que responden de los que no. Cuando las dos poblaciones se superponen, el punto de corte elegido determina el número de resultados falsos positivos y falsos negativos. En estos casos, la elección del punto de corte afecta al resultado final de un medicamento en la población tratada. Pueden consultarse detalles en una revisión sobre el papel de los biomarcadores en la medicina de precisión en una monografía reciente23.
La economía de la medicina estratificada, según Berndt y Trusheim, implica admitir menos pacientes elegibles (menor tamaño del mercado) para conseguir una mayor eficacia, impulsando una adopción más rápida, una mayor cuota de mercado, una mayor efectividad comparada para justificar mejor compensación y, ocasionalmente, mejores tasas de iniciación y adherencia del paciente 24. Cabe señalar, sin embargo, que su aportación se centra en biomarcadores prescriptivos, del tipo “companion diagnostics”, y que su prescripción es necesaria para la terapia farmacológica. Si adoptamos una perspectiva más amplia, la de medicina de precisión, tales afirmaciones deberían modularse convenientemente25. La incorporación de biomarcadores pronóstico y moderadores sobre tratamientos existentes y nuevos modificaría sustancialmente el alcance del mercado. Ahora bien, para ello necesitaríamos profundizar en el valor de los biomarcadores.
El valor de la medicina de precisión
La adopción de la medicina de precisión afecta tanto a la salud individual como a la poblacional. Tanto la perspectiva individual como la social tendrán que tenerse en cuenta en la definición de valor. Y si bien la efectividad es un requisito para que las tecnologías sean coste-efectivas, las preferencias sobre el umbral admisible de efectividad y coste-efectividad pueden diferir, como sucede en otras tecnologías. Pero hay cuestiones metodológicas singulares que representan un reto para la evaluación económica. Y en este sentido se ha reflejado suficientemente en múltiples artículos26 dos aspecots: (1) la dificultad inherente a la gestión, a la calidad y al análisis de datos y (2) la necesidad de marcos de evaluación más amplios.
La disponibilidad de grandes volúmenes de datos de múltiples fuentes, la necesidad de realizar enlaces de datos dentro de un entorno de procedimientos de acceso e intercambio de datos opacos se podría resolver si se mejoran los procedimientos para el intercambio de datos. Más allá de las dificultades concretas, la definición de los datos clave para la evaluación económica es un aspecto fundamental a considerar. Recientemente se ha formalizado una propuesta para dar respuesta a esta cuestión focalizada en la oncología de precisión27. Los autores consideran que la estandarización de los datos es un pre-requisito para que los resultados de la evaluación sean comparables y fiables. Es precisamente el esfuerzo y la inversión en crear bases de datos la que permitirá posteriormente una simulación dinámica. Las aproximaciones tradicionales (mediante Modelos de Markov) tienen dificultades prácticas en la aplicación a la medicina de precisión. Algunos autores proponen modelos de simulación dinámica, simulación discreta de acontecimientos o simulación basada en agentes, como alternativa28. Ello permitiría comprender escenarios de intervención y sus consecuencias desde una perspectiva sistémica.
Los Value assessment frameworks se han diseñado para proporcionar un conjunto de métodos y procesos para evaluar los beneficios y riesgos, y en algunos casos los costes y el valor agregado de las intervenciones sanitarias29. Algunos ejemplos de los 5 esquemas más destacables serían: European Society for Medical Oncology (ESMO) Magnitude of Clinical Benefit Scale, American Society of Clinical Oncology (ASCO) Value Framework (version 2.0), National Comprehensive Cancer Network (NCCN) Evidence Blocks, Memorial Sloan Kettering Cancer Center DrugAbacus, y el Institute for Clinical and Economic Review Value Assessment Framework30.
Según algunos autores31, para el caso de la medicina de precisión, los value assessment frameworks ya existentes32 necesitan readaptarse. Deberían profundizar aspectos como la interacción de biomarcadores y fármacos en la evaluación de tecnologías, en lugar de su evaluación se haga por separado. La utilidad clínica del biomarcador o incluso del algoritmo necesita entenderse en el marco del mecanismo de acción del medicamento o terapia y a menudo una terapia depende de diversos biomarcadores o incorpora algoritmos de inteligencia artificial, lo que añade complejidad a su evaluación y a su vez demanda un análisis conjunto.
A pesar del énfasis de los investigadores y expertos en la utilidad potencial de aprovechar la evidencia del mundo real (Real world evidence, RWE) para informar la toma de decisiones de cobertura de prestaciones, los financiadores han sido relativamente más lentos en adoptar su utilización en las evaluaciones de pruebas genéticas. El potencial sin embargo es elevado y así lo muestra una revisión reciente33. El artículo expone con detalle las distintas propuestas para la adopción de datos procedentes de RWE relativos a medicina de precisión.
Las consideraciones metodológicas en esta sección aplicadas a oncología de precisión pueden encontrarse explicadas con detalle y contextualizadas en un país como Canadá34. Es tan sólo un resumen más de la necesidad de mejorar las herramientas de la evaluación económica para la medicina de precisión e incorporar métodos y aproximaciones adicionales35 36 (Tabla 2).
La medicina de precisión supone el uso de un mecanismo para determinar la heterogeneidad entre pacientes que no se estaba disponible anteriormente. El uso de una prueba diagnóstica para medir un biomarcador predictivo de la respuesta diferencial al tratamiento y, en consecuencia, el coste incremental y los resultados de salud. Así pues, en la medicina de precisión, en teoría, el beneficio neto esperado de tratar a los pacientes según su subgrupo es mayor que el obtenido de una estrategia alternativa genérica. Es precisamente la estratificación de pacientes la opción que ofrecería una mayor capacidad de generación de valor, mediante la conocida frase “el tratamiento adecuado para el paciente y el momento adecuado”. Y el siguiente nivel sería la personalización del tratamiento, un ejemplo de ello sería la terapia del receptor antígeno quimérico de células T, CAR-T para leucemia linfoblástica. Hay biomarcadores y terapias que permiten estratificación, y otros que permiten personalización, ambos se encuentran bajo la denominación de medicina de precisión. La cuestión a dilucidar es si el alcance del coste efectividad incremental de la medicina de precisión.
|
Métodos y Disciplinas de Economía Aplicadas a la Medicina de Precisión. |
Utilidad |
|---|---|
|
Análisis de decisiones y modelos de simulación |
Definir los beneficios y riesgos clínicos potenciales cuando falta evidencia directa; ilustrar el impacto de la incertidumbre |
|
Evaluación económica basada en ensayos |
Estimaciones imparciales del impacto de una intervención en las acciones, los resultados y los costos de atención médica |
|
Marcos de valor y evaluación de preferencias |
Identificar el valor más allá del captado por los años de vida ajustados por calidad |
|
Análisis coste-efectividad
|
Guiar las prioridades de salud pública, las pautas y las políticas de reembolso |
|
Economía del comportamiento
|
Comprender las acciones de atención médica del paciente y del proveedor en respuesta a la información genómica |
|
Análisis del valor de la información |
Identificar las prioridades de investigación y aclarar los umbrales de evidencia |
|
Evaluación de políticas públicas Utilidad |
Comprender el impacto de las políticas regulatorias en la inversión y el acceso a la medicina de precisión |
Fuente: Veenstra DL, Mandelblatt J, Neumann P, Basu A, Peterson JF, Ramsey SD. Health Economics Tools and Precision Medicine: Opportunities and Challenges. Forum Health Econ Policy. 2020 Mar 5;23(1)
El valor de los biomarcadores
El valor generado por la medicina de precisión proviene de la combinación de dos productos: una prueba diagnóstica utilizada conjuntamente con el tratamiento de elección. Hay tres aspectos clave que nos definen el valor de un biomarcador37. En primer lugar, la validez analítica: la exactitud y reproducibilidad con que un biomarcador mide lo que con él se pretende medir. En segundo lugar, la validez clínica que nos indicar su capacidad para identificar un metabolito o una enfermedad mediante parámetros habituales: sensibilidad, especificidad, valores predictivos positivo y negativo, y razones de verosimilitud positiva y negativa. Y finalmente, la utilidad clínica, su capacidad para ofrecer información útil y segura (elevada relación beneficio/riesgo) sobre el diagnóstico y el tratamiento o prevención de una enfermedad. La utilidad clínica debe entenderse como la variable de resultado final en salud, el beneficio marginal en salud que aporta el uso clínico del biomarcador o la prueba diagnóstica. No hay utilidad clínica sin validez analítica, ni validez clínica. Así pues, la efectividad de un biomarcador es la condición previa para un análisis del coste-efectividad de una intervención de medicina de precisión, del mismo modo que lo es la terapia que lo acompaña.
Según Goldman et al.38 las pruebas diagnósticas transforman la medicina de precisión en un bien de de inspección (search good) en lugar de un bien de experiencia que sería la medicina empírica. En un bien de inspección la calidad puede inferirse antes de su consumo. En cambio, en un bien de experiencia solo puede conocerse la calidad después de haberlo consumido, y este sería el caso de la medicina empírica convencional.
Al convertir la medicina de precisión en un bien de inspección y permitir conocer la respuesta probable a una terapia antes del tratamiento, las pruebas de diagnóstico personalizadas ofrecen varias ventajas sobre un enfoque empírico de prueba y error de la medicina. Estos beneficios incluyen menores efectos secundarios, costes potencialmente menores de la terapia (por ejemplo, si se identifica que un paciente probablemente no responde a una terapia costosa y la alternativa es más barata), costes de oportunidad potencialmente menores de tiempo y un acceso mejor a una atención eficaz.
Ahora bien, las metodologías precisas para evaluar pruebas diagnósticas resultan complejas de adoptar en la práctica por su difícil estimación de los beneficios monetarios y de salud monetarios que aportan y sobre todo la dificultad de encontrar comparadores. Todo esto da lugar a que los estudios coste-efectividad de pruebas diagnósticas puedan observarse a menudo en un análisis conjunto biomarcador y terapia, en lugar de biomarcador únicamente39.
El coste-efectividad de la medicina de precisión
Ofrecer una conclusión agregada sobre lo que ha aportado la medicina de precisión en términos de coste-efectividad resulta arriesgado, por la diversidad de tratamientos y aproximaciones que incluye. Sabemos que, en oncología de precisión, Imatinib tiene una tasa de respuesta del 95 % en pacientes con leucemia mieloide crónica y prolonga en 9 años la vida ajustando por la calidad, o que Venetoclax tiene una tasa de respuesta del 80% en pacientes con leucemia linfocítica crónica. La nueva terapia de células T con receptor de antígeno quimérico (CAR-T) tiene una tasa de remisión del 62% a los 24 meses entre pacientes con leucemia linfoblástica aguda.
Ahora bien, tal como señala Cutler40, el impacto de la oncología de precisión en el cáncer es todavía limitado. Respecto al acceso, solo el 8% de los pacientes con cáncer serían elegibles, y el 5% habrían recibido tratamiento en 2018. Y respecto al coste, Cutler indica que sólo un número determinado de tratamientos superan la barrera del coste-efectividad si nos basamos en el Drug Abacus del Memorial Sloan Cancer Center.
Si nos aproximamos a las revisiones sistemáticas podemos tener un resumen singular de la cuestión, con todas las cautelas necesarias. Así por ejemplo, tomemos una revisión sistemática reciente que muestra el coste efectividad de 279 intervenciones de medicina de precisión analizadas en 128 artículos41. La mayoría de estudios fueron en tratamientos contra el cáncer (60%). Las pruebas de pronóstico (19 %) y las pruebas para identificar respuesta (37 %) fueron las menos y las más comunes, respectivamente. La mediana de QALYs incrementales, costes incrementales y Beneficio Monetario Neto incremental por persona fue de 0,03, 575$ y 18$, respectivamente. Los datos de QALYs sugieren que los beneficios para la salud de la medicina de precisión tienden a ser similares (o posiblemente ligeramente inferiores) a los beneficios para la salud de otras intervenciones de atención sanitaria. En esta revisión, la mediana del Beneficio Monetario Neto incremental de las intervenciones de medicina de precisión fue cercana a 0 ($18), lo que implica que los beneficios para la salud que ofrecerían las intervenciones de medicina de precisión se contrarrestan con los mayores costes asociados con las intervenciones. Podría ser que las intervenciones de medicina de precisión estén asociadas con costes más altos que las intervenciones que no son de medicina de precisión debido a las pruebas adicionales necesarias para la estratificación, pero no hay contraste al respecto.
En esta revisión sistemática, las intervenciones de medicina de precisión en cáncer generaron un Beneficio Monetario neto incremental más alto que las intervenciones de medicina de precisión para otras patologías y se encontró una gran heterogeneidad en la relación entre coste y efectividad. El análisis de regresión mostró que las terapias génicas se asociaron con incrementos de QALYs más altos que otras intervenciones. Cabe señalar sin embargo que estamos ante una revisión sistemática donde la consistencia de los datos es diversa, que ha buscado comparadores, pero que ambas cuestiones resultan difícilmente contrastables en la práctica. Lo mismo sucede en otra revisión anterior y que llegó a conclusiones similares42. Habrá que esperar a nuevas revisiones sistemáticas en el futuro.
Precios y contratos en medicina de precisión
La perspectiva convencional de fijación de precios en un mercado regulado como el farmacéutico ha tenido que enfrentarse a una nueva realidad de una prestación que incorpora biomarcador como requisito para la prescripción del fármaco. Y a su vez, estos biomarcadores son indicadores de pronóstico y resultado del tratamiento en la mayoría de ocasiones. Al mismo tiempo, la disponibilidad de datos del impacto individual del tratamiento ha avanzado notablemente, con la confluencia pues de Real World Data con Big Data. En este contexto, la incertidumbre inicial sobre el resultado del tratamiento puede contrastarse con la verificación ex-post. La revisión sistemática reciente realizada por Koleva et al.43 permite comprender el estado de situación actual.
La inercia en los sistemas de reembolso de medicamentos ha llevado a continuar con esquemas de precios convencionales en determinados casos. Por ejemplo, las terapias CAR-T, Kymriah® y Yescarta® para la leucemia linfoblástica aguda, se han reembolsado en Estados Unidos sobre la base del precio equivalente al coste de adquisición complementado con un pago adicional del 6 % de ese coste, mientras que en otras ocasiones se ha aumentado el reembolso por DRG44. En relación a las pruebas diagnósticas, en Estados Unidos se ha compensado mediante pago por acto médico, mientras que en Europa mayoritariamente se ha asumido en el presupuesto de los laboratorios hospitalarios, por la industria farmacéutica o aumentado la compensación por DRG.
Ahora bien, más allá de la inercia en el reembolso de medicamentos personalizados, el acceso a nuevos fármacos se ha planteado en un marco de acuerdos de riesgo compartido condicionados al resultado. El concepto tal como se ha definido por la OMS y OCDE 45 es: “Un acuerdo entre un fabricante y un pagador/proveedor que permite el acceso a (cobertura/reembolso de) una tecnología sanitaria sujeto a condiciones específicas. Estos acuerdos pueden utilizar una variedad de mecanismos para abordar la incertidumbre sobre el desempeño de las tecnologías o para gestionar la adopción de tecnologías a fin de maximizar su uso efectivo o limitar su impacto presupuestario”.
El papel de los precios en este contexto se diluye, lo relevante no es el precio unitario por la cantidad prescrita, sino cual es la compensación que recibe la industria farmacéutica por la aportación neta de valor en salud. Por ejemplo, las terapias CAR-T citadas anteriormente también han sido objeto de contratos de riesgo compartido en Europa y la situación actual muestra diferencias notables en los cinco países clave: Reino Unido, Francia, Alemania, Italia y España46. Una de las cuestiones a destacar es la aproximación individual versus la de cohorte a la hora de la evaluación. Mientras Inglaterra y Francia han considerado la opción de cohorte, el resto han establecido la individual. Así pues, el riesgo de un pago en exceso en el caso de menor resultado en salud, disminuye en Alemania, Italia y España antes del proceso de reevaluación del contrato. Las terapias CAR-T son una muestra del impulso que están tomando precisamente los acuerdos de riesgo compartido, si bien la singularidad de cada terapia requiere atención a los detalles.
Posiblemente uno de los acuerdos de pago por resultados que habrá que evaluar con mayor detalle es el relativo a Zolgensma®, medicamento para la atrofia muscular espinal47. El motivo es su elevado precio, 1,94 millones de euros. El acuerdo establece que se valorarán las funciones motora, respiratoria y bulbar a los a los 18, 30, 42, 54 y 66 meses con unos objetivos de resultados específicos. Además, el precio será revisado si se superan las previsiones de ventas de la compañía. Aparece al mismo tiempo pues, el concepto de techo de gasto, el gasto máximo presupuestariamente asumible.
El resultado de las experiencias en contratos de riesgo compartido en Catalunya ha mostrado que el impacto económico de la incertidumbre ha sido limitado. Los retornos recibidos por el financiador en estos contratos durante el período de estudio fueron 2,4 millones de euros, es decir, el 3,9% del gasto total en contratos de riesgo compartido que afectaba a 3017 pacientes y sólo aproximadamente el 0,06% del gasto total en medicamentos hospitalarios en Catalunya48.
En el momento actual hay múltiples aproximaciones al reembolso de las terapias de medicina de precisión. La revisión citada anteriormente43 las resume en la figura 2.
Figura 2. Modelos de financiación y reembolso en medicina personalizada

Notas: MEA managed entry agreement; ORBM Orphan Reinsurer and Benefit Managers; BRSA Performance-based risk-sharing agreement. 1. Used in reimbursing (Molecular) biomarkers including genotyping and phenotyping) and/or targeted therapy ;2. Used/proposed in reimbursing gene/cell therapies/ targeted therapy; 3. Proposed for reimbursing (Molecular) biomarkers including genotyping and phenotyping) and/or targeted therapy; 4. Proposed for reimbursing gene/cell therapies/ targeted therapy; 5. Mentioned as a potential application for reimbursing gene/cell therapies/targeted therapy
Cada uno de estos acuerdos se basan en basado en resultados o son financieros. Los contratos basados en resultados pueden ser cortos (un año) o a largo plazo, con pagos realizados por adelantado (sumas globales con reembolsos pagados en caso de bajo rendimiento), o en cuotas (según el logro de los hitos acordados). Los modelos basados en resultados podrían disminuir el riesgo financiero para los pagadores ya que los fabricantes compartirían el
coste en caso de fracaso del tratamiento. Y luego está la dimensión del riesgo, hasta qué puntos se comparte el riesgo o no, y por supuesto cuando se relacionan con resultados siempre hay cierto nivel de riesgo (cuadrante superior derecha).
La combinación de riesgo con techo de gasto (el caso del Ministerio de Sanidad en Zolgensma) supone que en la práctica estamos en un acuerdo de riesgo máximo asumible. Y, por consiguiente, el financiador limita el tope de riesgo a la vista de su límite presupuestario. Los criterios por los que se establece este límite son especialmente relevantes, ahora bien, si este límite se basa en las previsiones de ventas del fabricante, entonces no sería el financiador quien lo fija sino el fabricante (caso Zolgensma).
La evaluación de estos contratos resulta clave para comprender si consiguen su objetivo y las cláusulas de confidencialidad pueden limitar sustancialmente el acceso a la información pública sobre el coste. Lo que significa que la evaluación coste-efectividad resulta incierta más allá de los actores implicados con acceso a la información. Esta cuestión hay que valorarla en todas sus facetas, sin embargo, todos los argumentos no han sido explicitados al público. La cuestión a considerar sería profundizar en el motivo exacto para que un financiador público deba mantener la confidencialidad de este tipo de contratos o de acuerdos de precios convencionales.
Idealmente, los modelos de financiación y reembolso deberían asegurar que cualquier excedente que se genere se distribuya de manera justa entre las partes interesadas, sin embargo, esto es difícil de lograr o evaluar que se ha conseguido. Precisamente, la capacidad de disponer de información clínica sobre resultados de las terapias está permitiendo que los contratos de riesgo compartido puedan ser de aplicación en un mayor número de ocasiones.
En la medida que nos encontramos en un entorno de pagador único, (single payer) la medicina de precisión ha impulsado la adopción de contratos en lugar de una fijación de un precio uniforme que sería la perspectiva tradicional de mercado. La medicina de precisión, de alguna manera, está reflejando con mayor claridad la existencia de un oferente y un demandante en el mercado, estamos ante un monopolista y un monopsonista en la mayoría de ocasiones. En otras palabras, no hay opción para un precio competitivo. A pesar de que algunos49 han tratado de mostrar que la incertidumbre sobre los resultados no implica la superioridad de los precios variables sobre los precios uniformes, las hipótesis y el contexto que consideran es de un mercado eficiente y por consiguiente no es de aplicación en entornos de pagador único.
La literatura al respecto de los sistemas alternativos de pago de medicamentos es amplia y la evaluación del impacto de los contratos de riesgo compartido y según resultados ya empieza a estar disponible50. El debate sobre su continuidad en el futuro está abierto en Europa. Sin embargo, la cuestión clave se situará previsiblemente más en el impacto presupuestario que en el reparto de riesgos. El motivo fundamental es que el elevado precio estimado de partida que la industria establece en medicamentos de precisión obliga a los gobiernos (monopsonistas y aseguradores del riesgo poblacional de enfermar) a evaluar si la disponbilidad presupuestaria permite asumir las nuevas prestaciones.
La salud poblacional de precisión
Más allá de la perspectiva individual, podemos considerar el impacto poblacional de la medicina de precisión. La experiencia del sistema integrado de salud Geisinger en Estados Unidos resulta de interés para comprender como el conocimiento del exoma poblacional puede permitir cambios en la salud poblacional. El planteamiento de la iniciativa de salud comunitaria MyCode en 2014 pretendía secuenciar el exoma completo de la población que accedía voluntariamente a tal opción. A fecha de hoy 285.000 personas ya forman parte de la cohorte de estudio, de las cuales se ha secuenciado el exoma a 183.760 y se han encontrado 3.355 variantes que requieren determinada acción de carácter preventivo o terapéutico, un 2,6% de los casos, mayoritariamente en cáncer (43%) y enfermedades cardiovasculares (36%)51,52 53.
Este ejemplo nos muestra una aproximación poblacional a la medicina de precisión mediante el análisis del exoma. El origen del proceso está en la población y no en el individuo. En términos agregados, si todos los afiliados a Geisinger se incorporan a la cohorte, y reciben la prueba, se habrán detectado variantes genéticas que requieren determinada acción con impacto efectivo sobre la salud. La pregunta abierta es si este procedimiento es coste efectivo. En una revisión sistemática que se dirigía a población sino a individuos, mostró que la evidencia disponible para poder llegar a conclusiones en algún sentido54 En cambio, en un estudio de ámbito poblacional el modelo encontró que la detección de cáncer hereditario de mama y ovario en población de mujeres de 30 años se asoció con 75 menos casos de cáncer en general y 288 QALYs ganados por cada 100 000 mujeres examinadas, a un costo incremental de $25 millones frente a pruebas basadas en antecedentes familiares; el ratio de coste-efectividad incremental (ICER) fue de $87.70055.
Hay que esperar a mayor evidencia de la medicina de precisión en la salud poblacional. Se han iniciado experiencias, pero su adopción es todavía ocasional.
La confluencia de la Inteligencia Artificial con la Medicina de Precisión
En múltiples publicaciones se ha reflejado como el uso masivo de los datos y algoritmos modifica los patrones y conceptos tradicionales de la toma de decisiones clínicas. La consideración de la medicina como una ciencia de datos donde la inteligencia artificial puede contribuir decisivamente va abriéndose camino52. Torkamani et al.56 plantearon el término Medicina de Alta Definición para reflejar precisamente esta orientación. Lo definieron como la evaluación dinámica, gestión y comprensión de la salud individual medida por sus unidades más básicas. Ello se conseguiría mediante cuatro estadios: 1) Definición del punto de partida de la salud, 2) Prevención de alta definición, 3) Tratamiento de alta precisión y 4) Aprendizaje y aprovechamiento de los datos generados. Si incidimos en el tercer estadio observaremos que los autores se refieren a la medicina de precisión en todas sus facetas y en concreto como la bioinformática es una disciplina clave para poder implantarla. De esta forma se interrelaciona lo que representa la inteligencia artificial para la medicina. En un artículo posterior, Eric Topol57 ha detallado con ejemplos cual es el nivel de predictibilidad que aportan distintos algoritmos comparados con la decisión humana. El mensaje clave es que los algoritmos aportan la métrica de predicción de una cohorte, no necesariamente de un individuo por lo que la incertidumbre se mantiene. Hay que aprovechar la inteligencia artificial siendo consciente de su contribución. Ahora bien, lo que sucede es que a medida que aumentamos los datos, mejora también su precisión, y se aprende, es entonces cuando la incertidumbre puede reducirse si al mismo tiempo somos capaces de aislar ruido.
El reconocimiento sofisticado de patrones de enfermedad es el ámbito donde los algoritmos están concentrando todo su interés58. Los ejemplos en radiología o en anatomía patológica son ya una realidad en muchos hospitales. Una revisión sistemática que seleccionó 20 artículos59, señala la falta de comprensión del impacto de la inteligencia artificial en salud, y destaca que la mayoría de estudios son de minimización de costes. Las sinergias entre algoritmos y medicina se trasladarán a la práctica y obligarán a su evaluación como cualquier tecnología59 60.
Comentarios finales
La evolución del conocimiento biomédico implica una necesidad de actualización constante y selección de las opciones más coste-efectivas. Las afirmaciones que sirven para determinado momento acaban modificándose por nueva información y contextos diferentes. El coste-efectividad de la medicina de precisión requiere atender tanto a la dimensión de salud individual como poblacional. Mientras que la primera es cada día más clara, la segunda necesita mayor demostración. Es por ello que la afirmación de Cutler40 es especialmente oportuna: “La era de la medicina de precisión cuestiona el sistema de salud y el sistema de innovación biomédica”. Y se pregunta “¿Podemos convertir la revolución en el conocimiento del cuerpo humano en mejoras significativas en la salud de la población a un coste adecuado?” La primera dimensión a resolver es pues la efectividad y su medida.
Una respuesta posible se ha apuntado en una narrativa controvertida61 que ha enfatizado el acceso diferencial a la tecnología. Sin equidad de acceso no se podrán aprovechar los beneficios para la salud poblacional que aporta la medicina de precisión. Tal equidad de acceso viene soportada inicialmente por la cobertura de la prestación en el marco de un seguro de salud universal. La adopción de la medicina de precisión sin la capacidad de compensación de riesgos en un seguro obligatorio resulta difícil de imaginar. La segunda dimensión a afrontar tiene que ver pues con el acceso equitativo a la tecnología.
Y la tercera cuestión clave es la metodológica. Se han identificado múltiples aspectos que requieren un abordaje y estandarización para que la evaluación de tecnologías en la medicina de precisión sea consistente. Los avances de la última década han sido notables, pero en un momento de despegue y generalización de la tecnología es necesario afrontarlo.
Referencias
1. National Research Council. Toward Precision Medicine: Building a Knowledge Network for Biomedical Research and a New Taxonomy of Disease.; 2011. doi:10.17226/13284
2. PMC. THE PERSONALIZED MEDICINE REPORT 2020 · Opportunity, Challenges, and the Future. Published online 2020:1-72. Accessed March 18, 2022. http://www.personalizedmedicinecoalition.org/Userfiles/PMC-Corporate/file/PMC_The_Personalized_Medicine_Report_Opportunity_Challenges_and_the_Future.pdf
3. Lyman GH, Moses HL. Biomarker Tests for Molecularly Targeted Therapies — The Key to Unlocking Precision Medicine. N Engl J Med. 2016;375(1):4-6. doi:10.1056/nejmp1604033
4. Micheel CM, Nass SJ, Omenn GS, Policy HS. Evolution of Translational Omics Lessons Learned and the Path Forward.; 2012.
5. The IQVIA Institute. Supporting Precision Oncology. Targeted Therapies, Immuno-Oncology, and Predictive Biomarker-Based Medicines.; 2020. Accessed March 22, 2022. https://www.iqvia.com/-/media/iqvia/pdfs/institute-reports/iqvia-institute-supporting-precision-oncology-report.pdf
6. Jørgensen JT. The current landscape of the FDA approved companion diagnostics. Transl Oncol. 2021;14(6):101063. doi:10.1016/j.tranon.2021.101063
7. Concert Genetics. The Current Landscape of Genetic Testing.; 2017. Accessed March 22, 2022. http://www.concertgenetics.com/wp-content/uploads/2018/04/12_ConcertGenetics_CurrentLandscapeOfGeneticTesting2018.pdf
8. Khoury MJ, Bowen MS, Clyne M, et al. From public health genomics to precision public health: A 20-year journey. Genet Med. 2018;20(6):574-582. doi:10.1038/gim.2017.211
9. Conti R, Veenstra DL, Armstrong K, Lesko LJ, Grosse SD. Personalized medicine and genomics: challenges and opportunities in assessing effectiveness, cost-effectiveness, and future research priorities. Med Decis Making. 2010;30(3):328-340. doi:10.1177/0272989X09347014
10. O’Donnell JC. Personalized medicine and the role of health economics and outcomes research: issues, applications, emerging trends, and future research. Value Health. 2013;16(6 Suppl):S1-3. doi:10.1016/j.jval.2013.06.004
11. Annemans L, Redekop K, Payne K. Current methodological issues in the economic assessment of personalized medicine. Value Heal. 2013;16(6 SUPPL.):S20-S26. doi:10.1016/j.jval.2013.06.008
12. Willke RJ, Crown W, Del Aguila M, Cziraky MJ, Khan ZM, Migliori R. Melding regulatory, pharmaceutical industry, and U.S. payer perspectives on improving approaches to heterogeneity of treatment effect in research and practice. Value Heal. 2013;16(6 SUPPL.):S10-S15. doi:10.1016/j.jval.2013.06.006
13. Berndt ER, Goldman DP, Rowe J. Economic Dimensions of Personalized and Precision Medicine. University of Chicago Press; 2018. doi:10.7208/chicago/9780226611235.001.0001
14. Ginsburg GS, Phillips KA. Precision medicine: From science to value. Health Aff. 2018;37(5):694-701. doi:10.1377/hlthaff.2017.1624
15. Bayle A, Droin N, Besse B, et al. Whole exome sequencing in molecular diagnostics of cancer decreases over time: evidence from a cost analysis in the French setting. Eur J Heal Econ. 2021;22(6):855-864. doi:10.1007/s10198-021-01293-1
16. Contreras JL. Genome Defense: Inside the Epic Legal Battle to Determine Who Owns Your DNA. Published online 2021.
17. Nicol Di, Dreyfuss RC, Gold ER, Li W, Liddicoat J, Van Overwalle G. International Divergence in Gene Patenting. Annu Rev Genomics Hum Genet. 2019;20:519-541. doi:10.1146/annurev-genom-083118-015112
18. Storz U, Quodbach M, Marty SD, Constantine DE, Parker M. Biopatent Law: European vs. US Patent Law.; 2014. http://link.springer.com/10.1007/978-3-642-41293-6
19. Reuters. Breakthrough gene-editing technology belongs to Harvard , MIT -. Published online 2022:1-9. https://www.reuters.com/business/healthcare-pharmaceuticals/breakthrough-gene-editing-technology-belongs-harvard-mit-us-tribunal-2022-03-01/
20. Graham F. Daily briefing: CRISPR patent ruling won’t be the end of it. Nature. Published online March 10, 2022. doi:10.1038/d41586-022-00721-3
21. Trusheim MR, Berndt ER, Douglas FL. Stratified medicine: Strategic and economic implications of combining drugs and clinical biomarkers. Nat Rev Drug Discov. 2007;6(4):287-293. doi:10.1038/nrd2251
22. Rubin EH, Allen JD, Nowak JA, Bates SE. Developing precision medicine in a global world. Clin Cancer Res. 2014;20(6):1419-1427. doi:10.1158/1078-0432.CCR-14-0091
23. Ibern P, Campillo-Artero C. Los biomarcadores y la medicina de precisión, en Fundación Gaspar Casal. El Sistema Nacional de Salud ante la Medicina de Precisión. In: ; 2019. https://fundaciongasparcasal.org/wp-content/uploads/2020/12/ELSISTEMANACIONALDESALUD.pdf
24. Trusheim MR, Berndt ER. The clinical benefits, ethics, and economics of stratified medicine and companion diagnostics. Drug Discov Today. 2015;20(12):1439-1450. doi:10.1016/j.drudis.2015.10.017
25. Stern AD, Alexander BM, Chandra A. How economics can shape precision medicines. Science (80- ). 2017;355(6330):1131-1133. doi:10.1126/science.aai8707
26. Fahr P, Buchanan J, Wordsworth S. A Review of the Challenges of Using Biomedical Big Data for Economic Evaluations of Precision Medicine. Appl Health Econ Health Policy. 2019;17(4):443-452. doi:10.1007/s40258-019-00474-7
27. Pollard S, Weymann D, Chan B, et al. Defining a Core Data Set for the Economic Evaluation of Precision Oncology. Value Heal. Published online 2022. doi:10.1016/j.jval.2022.01.005
28. Marshall DA, Grazziotin LR, Regier DA, et al. Addressing Challenges of Economic Evaluation in Precision Medicine Using Dynamic Simulation Modeling. Value Heal. 2020;23(5):566-573. doi:10.1016/j.jval.2020.01.016
29. Institute for Clinical and Economic Review. 2020-2023 Value Assessment Framework. 2020;2020:1-76. http://www.icer-review.org/about/support/.
30. Walter E. Approaches to capturing value in oncology. In: Regulatory and Economic Aspects in Oncology. Vol 213. ; 2019:85-108. doi:10.1007/978-3-030-01207-6_7
31. Faulkner E, Holtorf AP, Walton S, et al. Being Precise About Precision Medicine: What Should Value Frameworks Incorporate to Address Precision Medicine? A Report of the Personalized Precision Medicine Special Interest Group. Value Heal. 2020;23(5):529-539. doi:10.1016/j.jval.2019.11.010
32. National Academies of Sciences Engineering and Medicine H and MDB on HCSB on the H of SPC on the EB for GT. An Evidence Framework for Genetic Testing. National Academies Press; 2017. doi:10.17226/24632
33. Deverka PA, Douglas MP, Phillips KA. Use of Real-World Evidence in US Payer Coverage Decision-Making for Next-Generation Sequencing–Based Tests: Challenges, Opportunities, and Potential Solutions. Value Heal. 2020;23(5):540-550. doi:10.1016/j.jval.2020.02.001
34. Chan KKW, Cheung MC, Regier DA, et al. The past, present, and future of economic evaluations of precision medicine at the committee for economic analyses of the canadian cancer trials group. Curr Oncol. 2021;28(5):3649-3658. doi:10.3390/curroncol28050311
35. Veenstra DL, Mandelblatt J, Neumann P, Basu A, Peterson JF, Ramsey SD. Health economics tools and precision medicine: Opportunities and challenges. Forum Heal Econ Policy. 2020;23(1):1-14. doi:10.1515/fhep-2019-0013
36. Kasztura M, Richard A, Bempong NE, Loncar D, Flahault A. Cost-effectiveness of precision medicine: a scoping review. Int J Public Health. 2019;64(9):1261-1271. doi:10.1007/s00038-019-01298-x
37. Genome-Based Diagnostics. National Academies Press; 2012. doi:10.17226/13359
38. Goldman DP, Gupta C, Vasudeva E, et al. The Value of Diagnostic Testing in Personalized Medicine. Forum Heal Econ Policy. 2013;16(2):121-133. doi:10.1515/fhep-2013-0023
39. Wurcel V, Perche O, Lesteven D, et al. The Value of Companion Diagnostics: Overcoming Access Barriers to Transform Personalised Health Care into an Affordable Reality in Europe. Public Health Genomics. 2016;19(3):137-143. doi:10.1159/000446531
40. Cutler DM. Early Returns from the Era of Precision Medicine. JAMA - J Am Med Assoc. 2020;323(2):109-110. doi:10.1001/jama.2019.20659
41. Vellekoop H, Versteegh M, Huygens S, et al. The Net Benefit of Personalized Medicine: A Systematic Literature Review and Regression Analysis. Value Heal. Published online 2022. doi:10.1016/j.jval.2022.01.006
42. Hatz MHM, Schremser K, Rogowski WH. Is Individualized Medicine More Cost-Effective? A Systematic Review. Pharmacoeconomics. 2014;32(5):443-455. doi:10.1007/s40273-014-0143-0
43. Koleva R, James K, Heleen B, Simone V, Matthijs H. Financing and Reimbursement Models for Personalised Medicine : A Systematic Review to Identify Current Models and Future Options. Appl Health Econ Health Policy. 2022;(0123456789). doi:10.1007/s40258-021-00714-9
44. Whittington MD, McQueen RB, Campbell JD. Valuing chimeric antigen receptor T-cell therapy: Current evidence, uncertainties, and payment implications. J Clin Oncol. 2020;38(4):359-366. doi:10.1200/JCO.19.01558
45. Dabbous M, Chachoua L, Caban A, Toumi M. Managed Entry Agreements: Policy Analysis From the European Perspective. Value Heal. 2020;23(4):425-433. doi:10.1016/j.jval.2019.12.008
46. Jørgensen J, Hanna E, Kefalas P. Outcomes-based reimbursement for gene therapies in practice: the experience of recently launched CAR-T cell therapies in major European countries. J Mark Access Heal Policy. 2020;8(1):1715536. doi:10.1080/20016689.2020.1715536
47. Ministerio De Sanidad. ACUERDOS DE LA REUNIÓN DE LA COMISIÓN INTERMINISTERIAL DE PRECIOS DE LOS MEDICAMENTOS. SESIÓN 211 DE 7 DE ABRIL DE 2021. Published online 2022. https://www.mscbs.gob.es/profesionales/farmacia/pdf/ACUERDOS_DE_LA_CIPM_2062_web.pdf
48. Guarga L, Gasol M, Reyes A, et al. Implementing Risk-Sharing Arrangements for Innovative Medicines: The Experience in Catalonia (Spain). Value Heal. Published online 2021:1-7. doi:10.1016/j.jval.2021.10.010
49. Hlávka JP, Yu JC, Goldman DP, Lakdawalla DN. The economics of alternative payment models for pharmaceuticals. Eur J Heal Econ. 2021;22(4):559-569. doi:10.1007/s10198-021-01274-4
50. Towse A, Fenwick L. It Takes Two to Tango: When do Conditional Reimbursement Risk-Sharing Schemes Work for Both Parties? | OHE. Off Heal Econ. https://www.ohe.org/publications/it-takes-two-tango-when-do-conditional-reimbursement-risk-sharing-schemes-work-both
51. Rodriguez PJ, Veenstra DL, Heagerty PJ, Goss CH, Ramos KJ, Bansal A. A Framework for Using Real-World Data and Health Outcomes Modeling to Evaluate Machine Learning–Based Risk Prediction Models. Value Heal. 2022;25(3):350-358. doi:10.1016/j.jval.2021.11.1360
52. Matheny M, Israni ST, Ahmed M. Artifical Intellingence in Health Care. Natl Acad Med. Published online 2018:1-269.
53. Williams MS, Buchanan AH, Davis FD, et al. Patient-centered precision health in a learning health care system: Geisinger’s genomic medicine experience. Health Aff. 2018;37(5):757-764. doi:10.1377/hlthaff.2017.1557
54. Schwarze K, Buchanan J, Taylor JC, Wordsworth S. Are whole-exome and whole-genome sequencing approaches cost-effective? A systematic review of the literature. Genet Med. 2018;20(10):1122-1130. doi:10.1038/gim.2017.247
55. Guzauskas GF, Garbett S, Zhou Z, et al. Cost-effectiveness of Population-Wide Genomic Screening for Hereditary Breast and Ovarian Cancer in the United States. JAMA Netw Open. 2020;3(10):1-14. doi:10.1001/jamanetworkopen.2020.22874
56. Torkamani A, Andersen KG, Steinhubl SR, Topol EJ. High-Definition Medicine. Cell. 2017;170(5):828-843. doi:10.1016/j.cell.2017.08.007
57. Topol EJ. High-performance medicine: the convergence of human and artificial intelligence. Nat Med. 2019;25(1):44-56. doi:10.1038/s41591-018-0300-7
58. Johnson KB, Wei WQ, Weeraratne D, et al. Precision Medicine, AI, and the Future of Personalized Health Care. Clin Transl Sci. 2021;14(1):86-93. doi:10.1111/cts.12884
59. Voets MM, Veltman J, Slump CH, Siesling S, Koffijberg H. Systematic Review of Health Economic Evaluations Focused on Artificial Intelligence in Healthcare: The Tortoise and the Cheetah. Value Heal. 2022;25(3):340-349. doi:10.1016/j.jval.2021.11.1362
60. Hendrix N, Veenstra DL, Cheng M, Anderson NC, Verguet S. Assessing the Economic Value of Clinical Artificial Intelligence: Challenges and Opportunities. Value Heal. 2022;25(3):331-339. doi:10.1016/j.jval.2021.08.015
61. Khoury MJ, Galea S. Will Precision Medicine Improve Population Health? Obstet Gynecol Surv. 2017;72(1):15-17. doi:10.1097/01.ogx.0000511937.49229.57
