Un nou tractament permet millorar símptomes clau de la síndrome de Williams-Beuren
Un nou tractament permet millorar símptomes clau de la síndrome de Williams-Beuren
Investigadors del Laboratori de Neurofarmacologia de la UPF, en col·laboració amb investigadors de diverses universitats i centres de recerca, han trobat alteracions en la funció del sistema endocannabinoide que, en modular-lo, podrien millorar considerablement alguns dels símptomes característics de la síndrome. L'estudi és de gran interès per a investigadors i metges del camp de les malalties genètiques humanes i s’ha publicat avui a la revista eLife.

Utilitzant un model in vivo que imita l'alteració genètica de la síndrome de Williams-Beuren, investigadors del Laboratori de Neurofarmacologia – NeuroPhar de la UPF, en col·laboració amb diverses universitats i centres de recerca, van trobar alteracions en la funció del sistema endocannabinoide que, en modular-lo, podien millorar considerablement alguns dels símptomes característics de la síndrome. L'estudi és de gran interès per a investigadors i metges del camp de les malalties genètiques humanes i s’ha publicat avui a la revista eLife.
La síndrome de Williams-Beuren és una malaltia rara que passa aproximadament en un de cada 7.500 naixements. Es caracteritza per una deleció en un dels dos parells del cromosoma 7 d’una regió que conté de 26-28 gens. Com que només hi ha una còpia d'aquests gens, aquests s'expressen a nivells per sota de la seva expressió típica. Les alteracions més comunes són uns trets facials característics, un comportament hipersociable amb interaccions interpersonals desinhibides, dèficit cognitiu (de lleu a moderat), alteracions cardíaques limitants, nivells alts de calci a la sang (hipercalcèmia), dificultat per recrear una representació en tres dimensions del voltant, fet que implica problemes de coordinació motora, i solen tenir una bona disposició musical. Fins ara no hi ha una teràpia curativa per a aquesta síndrome, però sí que hi ha tractaments específics per a alguns dels símptomes.
El sistema endocannabinoide és un sistema de neurotransmissió poc conegut i que resulta d'especial interès, ja que pot ser alterat mitjançant lligands exògens, a més dels propis del sistema. Un d'aquests lligands exògens és el cànnabis, que s'uneix a les proteïnes receptores específiques per als cannabinoides. Atès que aquest sistema pot ser farmacològicament modulat, i té un paper rellevant en funcions tals com l’aprenentatge, la memòria i la sociabilitat, així com regular altres múltiples funcions fisiològiques, l’equip d’investigadors va pensar que aquest sistema podia tenir un rol important en la modulació d'alguns símptomes.
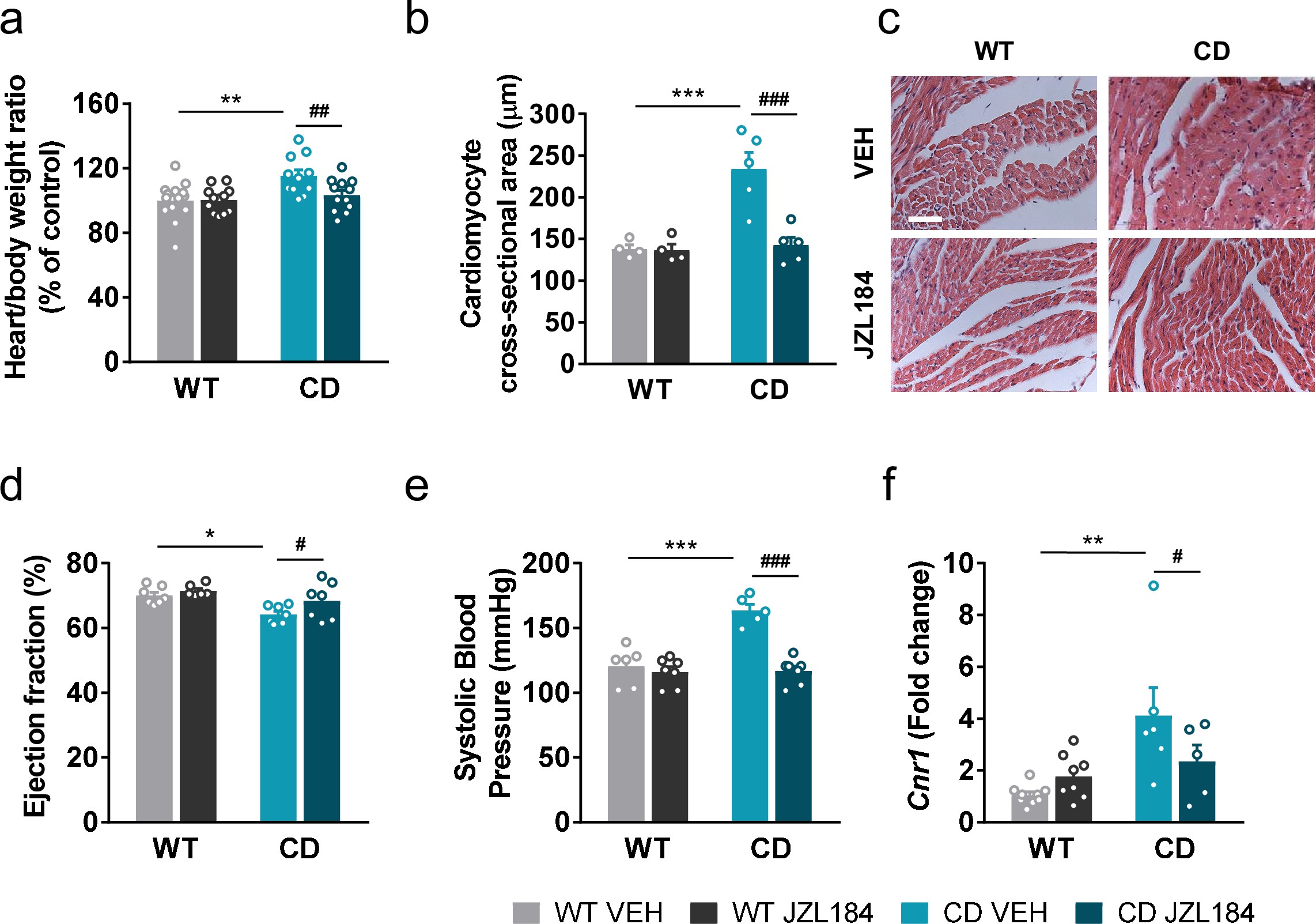
Van utilitzar un model de ratolí que imita la síndrome de Williams-Beuren a nivell genètic i que presenta fenotips representatius de la condició com ara la hipersociabilitat, el dèficit cognitiu, la hipertròfia del cor i la hipertensió arterial. Primer van estudiar les alteracions que presentava el sistema endocannabinoide a nivell del cervell observant que hi havia alteracions en l'expressió i la funcionalitat d'un dels receptors principals del sistema endocannabinoide, el receptor CB1.
"Per modular el sistema", expliquen Lorena Galera-Lopez, investigadora postdoctoral de NeuroPhar, i Alba Navarro-Romero, autores principals de l'estudi "utilitzem un tractament amb el fàrmac experimental JZL184 que s'encarrega d'inhibir un enzim que degrada endocannabinoides fent que augmentin els nivells endògens d'aquests endocanabinoides. Aquest fàrmac s'ha emprat prèviament per estudiar els efectes d'augmentar els nivells interns d'endocannabinoides a l'organisme i s'ha observat que pot tenir efectes antiinflamatoris al cervell, però se'n desconeixia els efectes en aquesta condició genètica”.
L'objectiu era veure si en modular el sistema endocannabinoide es podia revertir les alteracions presents al ratolí. Els resultats van mostrar que una administració del fàrmac durant 10 dies normalitzava alguns dels canvis d'activitat al receptor CB1 alhora que es van veure millores en els fenotips d'hipersociabilitat, els problemes de memòria, la hipertròfia del cor i la hipertensió.
Andrés Ozaita, investigador principal a NeuroPhar i professor del Departament de Medicina i Ciències de la Vida (MELIS) de la UPF, coautor de la investigació, explica que “el tractament amb el fàrmac funciona segons el context. En general, al ratolí control no es va observar cap canvi rellevant, mentre que al model de Williams-Beuren es van detectar canvis notables, cosa que indica que el fàrmac modula específicament aquesta condició. Per exemple, a nivell de cor, el canvi produït pel tractament en el model va ser molt substancial a nivell d'expressió gènica: al voltant del 70 per cent dels gens que estaven alterats a la condició genètica van tornar a nivells d'expressió típics, cosa que és un resultat força sorprenent”.
El pas següent en la investigació serà provar en el model animal molècules amb la capacitat de modular el sistema endocannabinoide, i que ja tinguin una aplicació clínica. “Ens interessa provar un altre tipus de molècules que puguin estar més a prop de la seva utilització clínica i que tinguin un efecte sobre el sistema endocannabinoide similar a la molècula que hem emprat”, explica Andrés Ozaita, “veure altres possibilitats terapèutiques per saber fins on podem reproduir els efectes positius que hem descrit”.
El model de ratolí emprat, que és el que millor imita l'alteració genètica que passa a l'humà, va ser desenvolupat per la investigadora Victoria Campuzano, directora del grup de Malalties genètiques del teixit conjuntiu i professora de la Facultat de Medicina i Ciències de la Salut de la Universitat de Barcelona i que també va participar a l’estudi.
Lorena Galera-López i Alba Navarro-Romero van treballar amb els animals realitzant els tractaments i les proves de conducta, així com les mesures anatòmiques i moleculars al cervell i cor.
La investigació va comptar amb la col·laboració de la Universitat de Barcelona, el Vall d’Hebron Institut de Recerca (VHIR), el Centre de Recerca Biomèdica en Xarxa de Malalties Rares (CIBERER), la Universitat Nacional d'Austràlia, la Universitat del País Basc, i l'Institut Hospital del Mar d'Investigacions Mèdiques ((IMIM-Hospital del Mar), entre d'altres.
Article de referència:
Navarro-Romero, Galera-López et al. eLife 2022;11:e72560. DOI: https://doi.org/10.7554/eLife.72560
