Las células cancerosas expuestas a alta viscosidad se mueven mejor y su potencial metastásico aumenta
Las células cancerosas expuestas a alta viscosidad se mueven mejor y su potencial metastásico aumenta
Las células cancerosas expuestas a alta viscosidad se mueven mejor y su potencial metastásico aumenta
Un equipo científico internacional, en el que participa el Laboratorio de Fisiología Molecular de la UPF, ha descubierto cómo las células cancerosas expuestas a ambientes de alta viscosidad cambian el modo de moverse para mejorar su invasividad y favorecer las metástasis. Los estudios, publicados en las revistas Nature y Nature Communications, proporcionan nuevas dianas para el diseño de posibles terapias contra el cáncer.

El cuerpo humano está formado por más de un billón de células que se unen entre sí para formar los tejidos y órganos de nuestros cuerpos. Sin embargo, las células son estructuras dinámicas que se mueven, con diferentes técnicas, a través del cuerpo para cumplir varias funciones, como por ejemplo cerrar heridas o llevar nutrientes a otros tejidos.
Comprender cómo se mueven las células cancerosas y toman decisiones en estos entornos confinados es importante ya que el 90% de las muertes relacionadas con el cáncer ocurren cuando se producen las metástasis.
Los laboratorios del Dr. Konstantinos Konstantopoulos de la Universidad Johns Hopkins y el del Dr. Miguel A. Valverde de la UPF, junto con equipos de EE. UU y Canadá, han colaborado durante los últimos seis años para desentrañar cómo las células cancerosas utilizan el movimiento de iones a través de canales iónicos activados mecánicamente -estímulos que deforman las membranas celulares- para adaptar su movimiento a diferentes tensiones mecánicas y entornos. Los resultados de esta investigación han sido publicados en dos estudios en las revistas Nature y Nature Communications.
En estos dos nuevos estudios, los científicos se han preguntado:
1) cómo las células cancerosas polarizan los mecanismos de transporte de iones en la parte delantera y trasera de las células para moverse a través de espacios estrechos, y
2) cómo las células cancerosas optimizan el movimiento cuando la viscosidad del fluido es elevada.
Para abordar estas importantes preguntas, se estudió el movimiento de las células en soportes tridimensionales generados con técnicas de bioingeniería, que se asemejan a las vías por las que las células normalmente se desplazan en nuestros cuerpos. Se localizaron dentro de la célula las proteínas clave mediante microscopia de alta resolución, se registró el volumen celular, los movimientos iónicos y la actividad eléctrica, además de evaluar cómo cambia la expresión de diferentes genes importantes para la evolución del cáncer.
Primer estudio: utilizar el agua como propulsión
En el primer estudio, publicado en Nature Communications, el equipo internacional descubrió que las células cancerosas pueden moverse en espacios confinados simplemente tomando agua en la parte frontal de la célula y liberándola en la parte posterior. Lo hacen sin necesidad de establecer interacciones moleculares con las paredes del tejido que las rodea. "Funciona como un propulsor hidráulico, similar al dispositivo que Tom Clancy llevó a la ficción para propulsar un submarino en su novela La caza del Octubre Rojo", explica el Dr. Miguel Valverde.
"Las células cancerosas pueden moverse en espacios confinados simplemente transfiriendo agua de la parte anterior a la posterior de la célula"
En la vida real, esto es posible porque las células acumulan en su parte frontal un sistema de transporte iónico, el intercambiador de sodio/protón (NHE1), que carga la célula con sodio lo que hace que aumente la presión osmótica y se favorezca la entrada de agua en la célula.
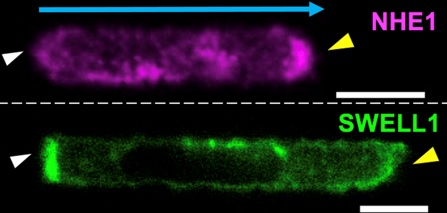
Al mismo tiempo, las células cancerosas concentran la proteína SWELL1 en su parte posterior. SWELL1 (también conocido como LRRC8A) es un canal de cloruro activado por aumentos en el contenido de agua celular que facilita la salida de cloruro y agua.
El resultado final de la acción coordinada de estos dos sistemas de transporte de iones en la parte delantera y trasera favorece el movimiento celular. Más importante aún, el estudio demuestra que la actividad de estos dos sistemas es esencial para el movimiento de las células cancerosas fuera de los vasos sanguíneos y en el desarrollo de metástasis.
Segundo estudio: moverse entre la viscosidad utilizando los músculos y el esqueleto celular
En el segundo estudio, publicado en Nature, los científicos se cuestionaron cómo los cambios en la viscosidad del entorno celular pueden condicionar la forma en que las células cancerosas se mueven y se comportan.
La viscosidad mide la resistencia que un fluido ejerce sobre cualquier cosa que se mueva en él o con él. Como tal, el sentido común y la ingeniería fundamental indican que las partículas inertes se mueven más lentamente en medios de viscosidad elevada.
Los científicos han demostrado ahora un efecto que a priori puede parecer contraintuitivo: La viscosidad elevada promueve la migración celular, la invasión, así como la extravasación de células tumorales -salida de los vasos sanguíneos- y la colonización pulmonar.
"A diferencia de las partículas inertes, las células expuestas a una viscosidad elevada se mueven más rápido"
“Las células de nuestro cuerpo están constantemente expuestas a fluidos de viscosidades variables”, continúa Valverde. “En algunas situaciones patológicas como es el crecimiento tumoral, la viscosidad local que rodea el tumor inicial aumenta debido a la degradación anormal de proteínas o la compresión de las vías normales de drenaje -los vasos linfáticos. Además, a medida que el cáncer progresa a otras partes del cuerpo, las células tienen que viajar a través de espacios llenos de fluidos intersticiales y sangre, que tienen una viscosidad más alta que la del agua”.
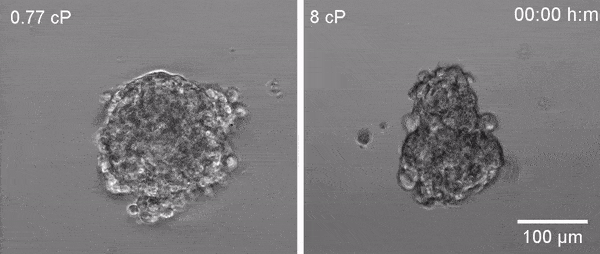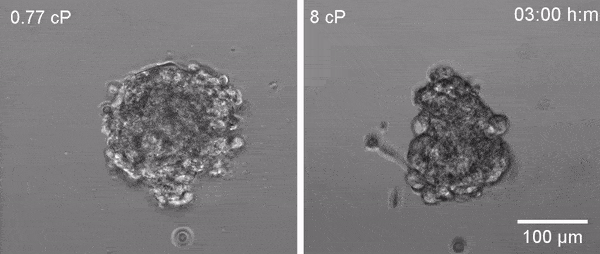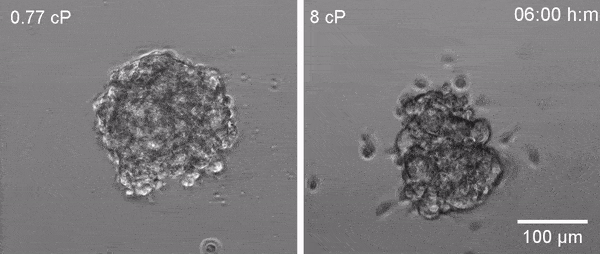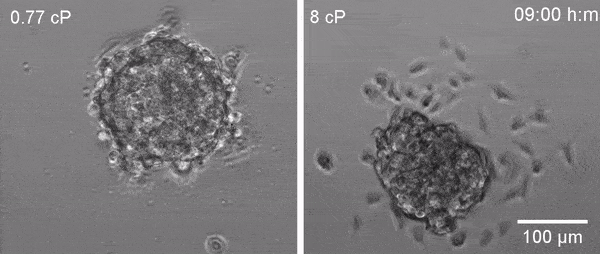
En estudios previos, el equipo de Valverde demostró que las células se adaptan a situaciones de alta viscosidad activando una proteína llamada TRPV4, un canal iónico que facilita la entrada de calcio en la célula, de otro modo imposible debido a la membrana lipídica que delimita la célula y que es impermeable a los iones. El calcio es un elemento que cuando se aumenta en el interior de la célula controla diversas funciones celulares.
Con estos antecedentes en mente, el equipo internacional de científicos planteó la hipótesis de que las células cancerosas expuestas a alta viscosidad pueden usar un mecanismo similar para promover su motilidad y diseminación. ¡¡¡Y tenían razón... pero con sorpresas interesantes!!!
Al exponer las células cancerosas a una alta viscosidad, observaron que el primer elemento celular que respondía a este estímulo era la proteína actina, que forma parte del esqueleto celular -citoesqueleto- y da forma al cuerpo celular. Esto inicia una cascada de eventos moleculares que termina con la activación del canal TRPV4, que a su vez activa una cascada de eventos intracelulares que resultan en el refuerzo del citoesqueleto celular y la activación de proteínas motoras.

Curiosamente, por medio de todos estos cambios las células modifican su modo de migración y ya no emplean el movimiento del agua. En estas condiciones, utilizan su “esqueleto y músculos" celulares, así como las interacciones con las paredes circundantes para impulsarse a una velocidad más rápida. En palabras de la Dra. Selma Serra de la UPF, coautora del estudio, "es como si las células hubieran ido al gimnasio para entrenarse duro -bajo altas cargas viscosas- y rendir mejor cuando se les desafía físicamente en su viaje desde el tumor primario hasta su destino final en una metástasis distante".
Los autores del estudio también encontraron que las células no solo se mueven más rápido cuando están rodeadas de fluidos de viscosidad elevada, sino también cuando han sido previamente expuestas a dichos fluidos y después se les han retirado. En otras palabras, las células no solo pueden detectar y responder a la viscosidad elevada, sino que también pueden desarrollar una memoria de su exposición a esta condición.
"Las células desarrollan memoria mecanobiológica para favorecer la diseminación del cáncer"
¿Cuán importante es lo que se ha descubierto?
La gran mayoría de la investigación en biología celular se realiza en medios de cultivo celular con viscosidades cercanas a la del agua. “En nuestro trabajo definimos por primera vez cómo las células detectan y responden a los niveles fisiológicamente relevantes de viscosidad del fluido en el que se encuentran comúnmente en el cuerpo de pacientes sanos y enfermos”, explica el Dr. Konstantopoulos, coordinador del estudio. “La definición del mecanismo molecular que utilizan las células para adaptarse a los cambios en la viscosidad del medio fue un tour de force en el cual tuvimos que cambiar nuestra idea preconcebida de qué elementos celulares son los primeros en responder a este tipo de estímulo mecánico”.
La gran coordinación entre los elementos estructurales de la células -su citoesqueleto de actinia y miosina- con los mecanismos de transporte iónico y agua que regulan el volumen celular supone un avance notable en nuestro entendimiento de la mecanobiología celular.
El Dr. Valverde explica el gran avance que supone demostrar que las células cancerosas tienen la capacidad de formar memoria en respuesta a la preexposición/precondicionamiento en viscosidades elevadas, y destaca la importancia del trabajo en equipo. “Nuestros trabajos también son un buen ejemplo de la necesidad de la colaboración multidisciplinar -bioingenieros, genetistas, biofísicos teóricos, biólogos celulares y fisiólogos- cada uno con un abordaje diferente pero complementario, que permite poder buscar respuestas a problemas complejos”, concluye.
¿Qué viene a continuación? Implicaciones para el desarrollo de fármacos
Será muy informativo examinar cómo los tumores primarios y las células cancerosas que se diseminan desde los tumores primarios, responden a los cambios locales en la viscosidad del líquido extracelular que se encuentran en el cuerpo durante la progresión de la enfermedad y durante la invasión en el microambiente tisular. El desarrollo y la optimización de biosensores que permitan la medición en tiempo real de la viscosidad del fluido extracelular junto con la obtención de imágenes de células cancerosas en animales vivos será crucial para abordar este punto. “En esta etapa, no podemos proponer una intervención molecular específica para combatir la metástasis del cáncer, pero creemos que las moléculas y la vía que identificamos en nuestro estudio se pueden usar como objetivos farmacológicos para posibles terapias contra el cáncer”, explica Valverde.
El trabajo ha sido parcialmente financiado con fondos provenientes del Ministerio de Ciencia, Educación y Universidades (RTI2018-099718-B-100), el programa de excelencia en investigación y desarrollo “Maria de Maeztu” y fondos FEDER al Dr. Miguel A. Valverde
Artículos de referencia:
Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis
Yuqi Zhang, Yizeng Li, Keyata N. Thompson, Konstantin Stoletov, Qinling Yuan, Kaustav Bera, Se Jong Lee, Runchen Zhao, Alexander Kiepas, Yao Wang, Panagiotis Mistriotis, Selma A. Serra, John D. Lewis, Miguel A. Valverde, Stuart S. Martin, Sean X. Sun & Konstantinos Konstantopoulos. Nature Communications volume 13, Article number: 6128 (2022) https://doi.org/10.1038/s41467-022-33683-1
Extracellular fluid viscosity enhances cell migration and cancer dissemination.
Kaustav Bera, Alex Kiepas, Inês Godet, Yizeng Li, Pranav Mehta, Brent Ifemembi, Colin D. Paul, Anindya Sen, Selma A. Serra, Konstantin Stoletov, Jiaxiang Tao, Gabriel Shatkin, Se Jong Lee, Yuqi Zhang, Adrianna Boen, Panagiotis Mistriotis, Daniele M. Gilkes, John D. Lewis, Chen-Ming Fan, Andrew P. Feinberg, Miguel A. Valverde, Sean X. Sun, Konstantinos Konstantopoulos. Nature (2022) www.nature.com/articles/s41586-022-05394-6
