Descubren cómo las células controlan "el corte final" durante la división celular
Descubren cómo las células controlan "el corte final" durante la división celular
Una nueva investigación ha identificado cómo las células utilizan el canal iónico mecanosensible Piezo1 para coordinar una de las propiedades fundamentales de una célula, su división en dos células hijas. Estos hallazgos sientan las bases para comprender esta etapa fundamental para el crecimiento y renovación de nuestros órganos y allana el camino para abordar la proliferación descontrolada de células cancerosas.

La división celular es uno de los períodos más críticos del crecimiento y homeostasis de los órganos. Las células del cuerpo proliferan a diferentes velocidades. Algunas se dividen constantemente y durante toda la vida, como los que recubren el intestino, mientras que otras se dividen solo en raras ocasiones. La división celular es un proceso fundamental para la biología, pero también para las enfermedades.
"La división celular es un proceso físico de alta fidelidad que termina con la separación en dos células hijas, un proceso conocido como citocinesis".
La citocinesis, la separación de una célula en dos células hijas, se inicia con el estrangulamiento de la célula madre alrededor del ecuador por los filamentos que forman el esqueleto de la célula. A continuación, la contracción de las células en el ecuador y el movimiento centrífugo de las células hijas inducen el estrechamiento de la conexión entre las células hijas (Imagen 1). “Es como separar un chicle formando un fragmento largo y fino que acaba por romperse”, comenta Miguel A. Valverde, responsable del Laboratorio de Fisiología Molecular de la UPF y líder del proyecto. El tramo largo y delgado de la membrana plasmática y el citoplasma que conecta las dos células hijas se llama puente intercelular y el corte final que da como resultado dos células separadas se llama abscisión.
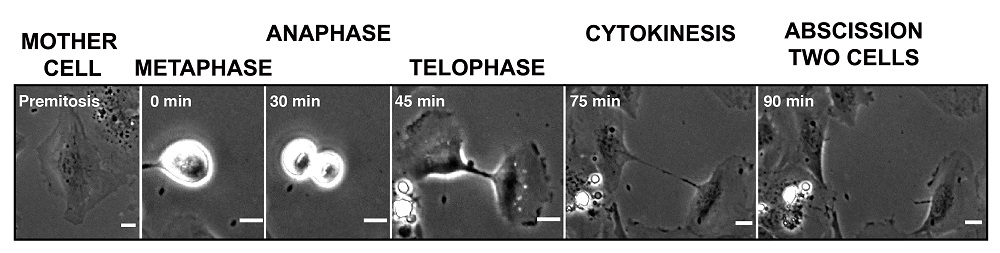
Sin embargo, existe una gran diferencia entre la rotura pasiva del chicle debido a la fuerza mecánica aplicada al estirar y la fascinante maquinaria de precisión de la abscisión. En el caso de la abscisión, el adelgazamiento del puente intercelular forma un tubo de menos de un micrómetro (10-6 metros) de diámetro con el objetivo de adaptar su forma y tamaño al anclaje de las proteínas con forma de muelle cónico –y sus reguladores– que estrangulan la membrana plasmática para generar dos células independientes. “Este corte final es un paso crítico en la división celular. No puede ocurrir demasiado pronto porque las células hijas podrían no recibir toda la información requerida, ni demasiado tarde porque las células hijas que se separan podrían fusionarse nuevamente en una sola célula, pero con dos núcleos, adquiriendo así un número incorrecto de cromosomas, lo que se conoce como aneuploidía, una característica significativa de numerosos tipos de cáncer”, afirma la Dra. Cristina Pujades, investigadora principal del grupo de Biología del Desarrollo de la UPF.
“El cáncer es a menudo el resultado de mutaciones en el ADN o problemas en la división de las células”.
Desde el descubrimiento en el siglo XIX de que las células se dividen, los científicos han tratado de desentrañar los mecanismos que operan en este proceso de alta precisión. “Razonamos que durante la formación del puente intercelular entre las células hijas se produce una tensión de la membrana plasmática que puede activar canales iónicos mecanosensibles”, dice la Dra. Julia Carrillo, primera autora de la publicación científica.
El calcio que ingresa a la célula después de la activación de Piezo1 promueve el reclutamiento de las proteínas que forman el muelle cónico que estrangula la conexión intercelular entre las células hijas.
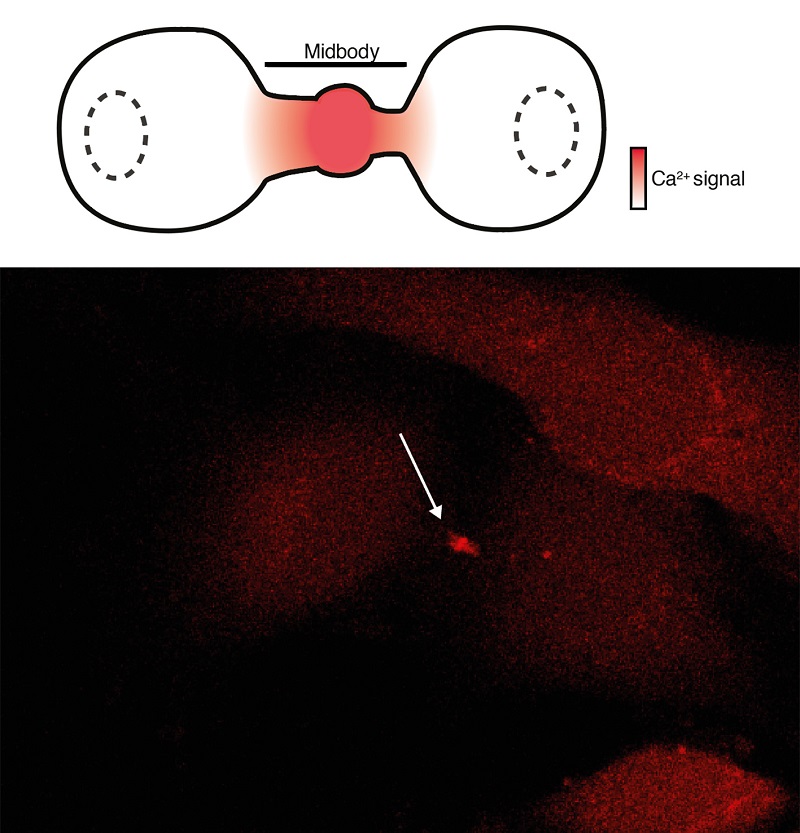
El equipo de la UPF descubrió que, durante la citocinesis, el canal iónico mecanosensible Piezo1 se activa casi de forma única en el puente intercelular donde genera una señal de calcio que se difunde (Imagen 2). Además, encontraron que Piezo1 es necesario para una citocinesis exitosa en diferentes tipos de células, incluidas las células endoteliales que recubren el interior de los vasos sanguíneos, las células que curan nuestras heridas, las células del cáncer de mama o en organismos completos como los embriones de pez cebra. En estos la actividad de Piezo1 se redujo mediante silenciamiento genético o una toxina obtenida de un escorpión que se une específicamente al canal Piezo1 inhibiendo su función.
Las proteínas de los canales iónicos Piezo fueron identificadas en 2010 como sensores rápidos de fuerzas mecánicas por el premio Nobel de este año, Ardem Patapoutian, y poco después fueron reconocidas como las moléculas que nuestro sistema nervioso usa para sentir el tacto. “Desde su descubrimiento, nosotros y otros laboratorios hemos propuesto que los canales Piezo no solo son relevantes para detectar el mundo en el que vivimos, sino que también son utilizados por las células para detectar y reaccionar a su entorno físico cuando se estiran, comprimen o se mueven dentro de nuestro cuerpo”, afirma el Dr. Valverde.
Piezo1 es necesario para una citocinesis exitosa en diferentes tipos de células y especies.
Estos hallazgos sientan las bases para comprender esta breve y dinámica etapa de la vida celular que es fundamental para el crecimiento y la renovación de nuestros órganos y allana el camino para abordar la proliferación descontrolada de células cancerosas en tumores mediante la regulación genética o farmacológica del canal Piezo1.
Financiación:
Financiado por el Ministerio de Ciencia, Educación y Universidades de España a través de las subvenciones RTI2018-099718-B-100 a Miguel A. Valverde y PGC2018-095663-B100 a Cristina Pujades, un Programa institucional “Maria de Maeztu” de Unidades de Excelencia en I + D al Departamento de Ciencias Experimentales y de la Salud (UPF) y fondos FEDER.
Artículo de referencia:
The mechanosensitive Piezo1 channel controls endosome trafficking for an efficient cytokinetic abscission. Julia Carrillo-Garcia, Víctor Herrera-Fernández, Selma A. Serra, Fanny Rubio-Moscardo, Marina Vogel-Gonzalez, Pablo Doñate-Macian, Covadonga F. Hevia, Cristina Pujades, Miguel A. Valverde. Science Advances 2021; 7: eabi7785, 29 October 2021. DOI: 10.1126/sciadv.abi7785.
