Definen el mecanismo molecular que impulsa el estadio inicial de la metástasis tumoral
Definen el mecanismo molecular que impulsa el estadio inicial de la metástasis tumoral
Un equipo internacional de científicos ha definido el mecanismo molecular que impulsa el paso inicial de la metástasis tumoral: la entrada de células tumorales a vasos vasculares y/o linfáticos, un proceso llamado intravasación. Comprender cómo las células tumorales escapan del tumor primario y entran en la vasculatura es un paso clave para identificar la malignidad del tumor y diseñar estrategias de tratamiento de la enfermedad.

Una nueva investigación realizada en las Universidades Johns Hopkins (EE. UU.), Alberta (Canadá) y Pompeu Fabra (Barcelona, España) ha definido el mecanismo molecular que impulsa el paso inicial de la metástasis tumoral —intravasación—, que consiste en la entrada de células tumorales en vasos vasculares y/o linfáticos.
La progresión metastásica es, con mucho, el aspecto más letal del cáncer, y es responsable del 90% de las muertes totales relacionadas con esta enfermedad. La metástasis es la diseminación de células tumorales a órganos distantes del tumor inicial o primario e implica el transporte de células neoplásicas a través de la vasculatura en nuestro cuerpo. Por lo tanto, comprender cómo las células tumorales escapan del tumor primario y entran en la vasculatura (un proceso denominado intravasación) es un paso clave para identificar la malignidad del tumor y diseñar estrategias de tratamiento de la enfermedad.
La capacidad de la célula para adquirir propiedades mecánicas específicas para hacer frente a los entornos cambiantes determina sus capacidades metastásicas y la malignidad de los tumores.
Durante el viaje de una célula tumoral desde su ubicación primaria hasta una metástasis distante, debe enfrentarse a diversos y cambiantes estreses mecánicos externos que desafían su supervivencia y progresión. La capacidad de la célula para adquirir propiedades mecánicas específicas para hacer frente a los entornos cambiantes, junto con otras señales químicas y genéticas, determinará las capacidades metastásicas y, a menudo, la malignidad de los tumores.
Los laboratorios del Dr. Konstantinos Konstantopoulus en la Universidad Johns Hopkins y el Dr. Miguel A. Valverde en la Universitat Pompeu Fabra (UPF) han estado colaborando durante los últimos 6 años para desentrañar muchos de los mecanismos que utilizan las células cancerosas para adaptarse a diferentes tensiones mecánicas y entornos para seguir desplazándose. En su nuevo estudio publicado en Science Advances, el equipo también unió fuerzas con el laboratorio del Dr. John Lewis (Canadá) para responder una pregunta de suma importancia en el cáncer: ¿qué factores determinan la intravasación de una célula tumoral?
Los investigadores han estudiado el movimiento celular a través de estructuras en 3D realizados mediante bioingeniería que imponen un confinamiento controlado de las células, que se asemeja a las vías que las células normalmente encuentran en nuestros cuerpos. Al mismo tiempo, tomaron imágenes de los flujos de iones y registraron la actividad eléctrica celular que controla las respuestas adaptativas celulares, tareas en las que la contribución de la Dra. Selma A. Serra y Julia Carrillo del Laboratorio de Fisiología Molecular de la UPF ha sido esencial.
“El escenario al que se enfrenta una célula que quiere moverse de una parte del cuerpo a otra utilizando los vasos sanguíneos o linfáticos es como el escenario que experimentan las personas que practican rafting en un río agitado. Los amantes de estos deportes de aventura saben que los rápidos de agua no son el mejor lugar para lanzar su bote al agua. En cambio, las aguas tranquilas son más favorables para que toda la tripulación suba a bordo y empiece a navegar sin marearse al tocar el agua”, dice Miguel A. Valverde. De manera similar, se sabía que la intravasación celular ocurre preferentemente en regiones de flujo de líquido reducido -con bajo estrés mecánico- porque el flujo de líquido bajo facilita la supervivencia de las células tumorales en la circulación. Entonces, una pregunta interesante es: ¿cómo saben las células si hay un flujo de líquido alto o bajo cuando se asoman al vaso sanguíneo?
Para determinar cómo las células responden al flujo de líquido cuando entran a un vaso, los investigadores modelaron la transición de la migración a la intravasación utilizando un dispositivo de microfluidos donde las células se mueven dentro de túneles longitudinales que se abren a una cámara ortogonal en la que se controla el flujo de líquido. En sus estudios, los investigadores analizaron la contribución de diferentes canales iónicos, proteínas que se encuentran en la membrana plasmática, que se especializan en respuestas rápidas a los cambios en las condiciones físicas del medio. Identificaron el sensor molecular de flujo de fluido, el canal de iones TRPM7. Este canal se activa cuando la célula está expuesta a un mayor flujo de líquido en su entorno y promueve la entrada de calcio en las células. El calcio actúa como una señal para orquestar diferentes proteínas a cargo del “volante” de las células. Como resultado de este proceso, las células cambian de dirección regresando por el mismo túnel estrecho en lugar de salir al espacio abierto, es decir, evitan las “aguas salvajes del río”.
Comprender la intravasación de las células tumorales es la clave para futuros desarrollos terapéuticos para bloquear la propagación de las células tumorales desde su sitio primario, antes del inicio de la metástasis.
El equipo de investigación internacional pasó a probar si la cantidad y la actividad de los canales TRPM7 presentes en las células tumorales pueden ser un elemento clave para determinar si una célula tumoral tiene una capacidad de intravasación baja o alta. Para ese propósito, diseñaron genéticamente células tumorales con cantidades bajas o altas de canal TRPM7 que brillan en verde cuando se exponen a una luz controlada. Usando un potente sistema de microscopio que sigue el movimiento de estas células dentro de un embrión de pollo vivo, pudieron asociar niveles bajos de TRPM7 con una mayor intravasación y metástasis a distancia.
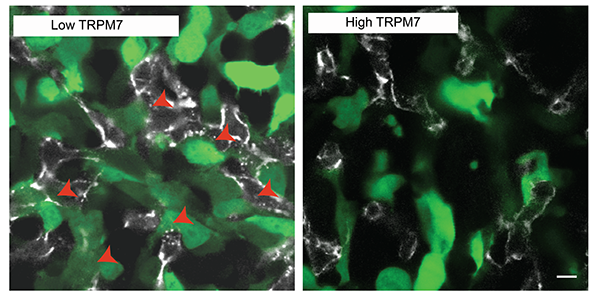 Concluyeron su investigación proponiendo que las células cancerosas reprimen este mecanismo, controlado por TRPM7, para intravasar y facilitar la metástasis a distancia. Los investigadores también apuntan que una mejor comprensión sobre la intravasación de células tumorales es la clave para futuros desarrollos terapéuticos para bloquear la propagación de las células tumorales desde su sitio primario, antes del inicio de la metástasis. “Necesitaremos más estudios antes de que podamos llevar esto al entorno clínico, pero creemos que brindamos, por primera vez, una imagen definitiva del papel de TPRM7 en un paso crucial de la metástasis tumoral", afirma Konstantopoulos.
Concluyeron su investigación proponiendo que las células cancerosas reprimen este mecanismo, controlado por TRPM7, para intravasar y facilitar la metástasis a distancia. Los investigadores también apuntan que una mejor comprensión sobre la intravasación de células tumorales es la clave para futuros desarrollos terapéuticos para bloquear la propagación de las células tumorales desde su sitio primario, antes del inicio de la metástasis. “Necesitaremos más estudios antes de que podamos llevar esto al entorno clínico, pero creemos que brindamos, por primera vez, una imagen definitiva del papel de TPRM7 en un paso crucial de la metástasis tumoral", afirma Konstantopoulos.
Artículo de referencia:
The fluid shear stress sensor TRPM7 regulates tumor cell intravasation. Christopher L. Yankaskas, Kaustav Bera, Konstantin Stoletov, Selma A. Serra, Julia Carrillo-Garcia, Soontorn Tuntithavornwat, Panagiotis Mistriotis, John D. Lewis, Miguel A. Valverde, Konstantinos Konstantopoulos. Science Advances 7 : eabh3457 9 July 2021.
Financiación
Financiado por los Institutos Nacionales de Salud (EE.UU.), Alberta Cancer Foundation (Canadá), Ministerio de Economía y Competitividad, el Programa “María de Maeztu” para Unidades de Excelencia (España) y fondos FEDER.
